
题目列表(包括答案和解析)
碳是组成物质种类最多的元素.
(1)碳元素在元素周期表中的位置是第________周期________族.
碳有612C、613C、614C三种原子,它们互称为________.
(2)金刚石、石墨、C60三种碳单质互称为________.
C60的晶体类型是________,金刚石中碳原子的轨道杂化方式是________,石墨晶体中存在的作用力有________.
(3)利用碳的低价氧化物CO可以合成化工原料COCl、配合物Fe(CO)5等.
①COCl分子的结构式为![]() ,分子中C原子的杂化轨道方式是________;按原子轨道重叠方式判断COCl分子中的化学键类型为________.
,分子中C原子的杂化轨道方式是________;按原子轨道重叠方式判断COCl分子中的化学键类型为________.
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断Fe(CO)5的晶体类型为________;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5![]() Fe(s)+5CO,反应过程中,断裂的化学键只有配位键.形成的化学键是________.
Fe(s)+5CO,反应过程中,断裂的化学键只有配位键.形成的化学键是________.
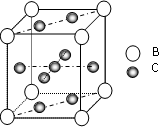
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________.


A.(物质结构与性质)A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3 倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为_____________,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于_____________,A与C所形成的化合物的熔、沸点明显高于A与C的同主族元素所形成的化合物的熔、沸点,其原因是_____________________________________________________________________。
(2)当n=2时,B原子的结构示意图为_________,B与C形成的晶体属于________晶体。
当n=3时,B与C形成的晶体中,B原子的杂化方式为________________________,该晶体中最小的环共有________个微粒构成,微粒间的作用力是____________________________。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是_____________,A、B、C、D四种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
B.(实验化学 )某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。

(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100 mL气体A进行实验,实验记录如下:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
B中的现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为_____________。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?_____________(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?_____________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
a | 在烧瓶中加热适量浓硝酸 4HNO3 | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
b | 加热AgNO3固体 2AgNO3 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
c | 加热Cu(NO3)2固体 2Cu(NO3)2 | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a.__________,原因是__________________________________________________。
b.__________,原因是__________________________________________________。
c.__________,原因是__________________________________________________。
(15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。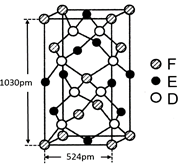
 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com