
题目列表(包括答案和解析)
汽车尾气中含有NOx、CO及碳氢化合物,直接排入空气会造成大气污染,某研究性学习小组拟探究汽车尾气相关问题,请你参与并回答问题。
(1)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应
CO(g)=c(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1.K-1,这一方案理论上是否可行,____________(选填:“可行”或“不可行”)。
![]() (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
(2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
①上述反应的平衡常数表达式为:_________________________。
②下列有关说法正确的是_____________________________
A.减少CO和NO浓度的有效方法是加长汽车尾气排气管的长度
B.提高NO及CO转化率的有效方法是低温催化
C.汽车尾气中的NO主要是由于石油中含有大量的氮元素
D.使用催化剂,在适当温度和压力下有利干提高上述反应转化效率
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2o2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积 B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间 D.两种氮氧化物的体积比
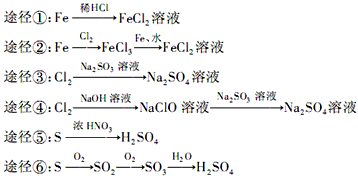
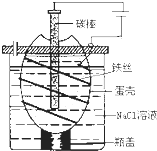 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
点评:有机合成是有机部分的重头戏,能综合考查学生对该有机基础知识掌握情况,新课标对这类题的考查特点是注重知识的广度。
猜题四 现代物理分析方法与有机结构探究相结合
例5某研究性学习小组为确定某蜡状有机物A的结构和性质,他们拟用传统实验的手段与现代技术相结合的方法进行探究。请你参与过程探究。
1、实验式的确定
(1)取样品A进行燃烧法测定。发现燃烧后只生成 ,某次燃烧后,经换算得到了
,某次燃烧后,经换算得到了 。据此得出的结论是________________________。
。据此得出的结论是________________________。
(2)另一实验中,取 蜡状A在
蜡状A在 (标准状况下,下同)氧气中完全燃烧,两者均恰好完全反应,生成
(标准状况下,下同)氧气中完全燃烧,两者均恰好完全反应,生成 和液态水。
和液态水。
由此得出的实验式是_____________________。
2、结构式确定(经测定A的相对分子质量为136)
(3)取少量样品熔化,加入钠有氢气放出,说明A分子中含有________基。
(4)进行核磁共振,发现只有两个特征峰,且面积比为8:4,再做红外光谱,发现与乙醇一样透过率在同一处波数被吸收。图谱如下:

则A的结构简式为______________________。
3、性质探究
(5)A的四乙酸酯在稀硫酸催化下在 中发生水解的化学方程式(产物中注明
中发生水解的化学方程式(产物中注明 )为___________________________________。
)为___________________________________。
(6)已知①

②甲醛是所有醛中还原性最强的,则合成A需要的两种醛是__________、_____________(填结构简式)
解析:样品燃烧只生成CO2和H2O,说明该有机物中一定含有C、H两种元素,可能含有O元素,结合量可以得出的结论是 (x=0、1、2…),根据
(x=0、1、2…),根据 A在
A在 (标准状况下)氧气中恰好完全燃烧,生成
(标准状况下)氧气中恰好完全燃烧,生成 和液态水。可以求出实验式为
和液态水。可以求出实验式为 。样品熔化后加入钠块有H2放出,则说明其中有羟基。由核磁共振,发现只有两个特征峰,且面积比为8:4,可以断定该有机物中的氢原子有两种,其数目之比为8:4;再由红外光谱,发现与乙醇一样透过率在同一处波数被吸收,可以断定该有机物中键的种类和醇一样;从而确定该有机物的结构简式为C(CH2OH)4。酯的水解实质是酯基断裂,碳氧单键上结合H原子,而碳氧双键上结合羟基,所以含有18的氧原子应在乙酸的羟基上。所以A的四乙酸酯在稀硫酸催化下,在
。样品熔化后加入钠块有H2放出,则说明其中有羟基。由核磁共振,发现只有两个特征峰,且面积比为8:4,可以断定该有机物中的氢原子有两种,其数目之比为8:4;再由红外光谱,发现与乙醇一样透过率在同一处波数被吸收,可以断定该有机物中键的种类和醇一样;从而确定该有机物的结构简式为C(CH2OH)4。酯的水解实质是酯基断裂,碳氧单键上结合H原子,而碳氧双键上结合羟基,所以含有18的氧原子应在乙酸的羟基上。所以A的四乙酸酯在稀硫酸催化下,在 中发生水解的化学方程式为
中发生水解的化学方程式为 ;
;
根据醛和醛加成能得到含有羟基的醛,最后再把醛基还原得到多元醇。

甲醛和乙醛以3:1进行加成得再加成H2得到C(CH2OH)4
答案:(1)分子中 ,分子式为
,分子式为
(2) (3)羟基
(3)羟基
(4)C(CH2OH)4
(5)
(6)
猜题五、化学与奥运会
例6.青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成份为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是
A.透闪石的化学式写成氧化物的形式为:2CaO?5MgO?8SiO2?H2O
B.透闪石的化学式写成硅酸盐的形式为:2CaSiO3?5MgSiO3?H2SiO3
C.透闪石中Mg元素的质量分数是Ca元素质量分数的2倍
D.透闪石中还有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等。
答案:C
解析:从化学式可知,Ca与Mg的物质的量比为2∶5,质量比为2×40∶5×24=80∶120,故质量分数比为2∶3,即Mg元素的质量分数是Ca元素的1.5倍。正确选项为C。
例7.2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol。
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol。
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol。
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol。
下列有关说法正确的是
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol。
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol。
D.人类利用的能源都是通过化学反应获得的
解析:A项中燃烧热不能带负号;B选项中等质量的烷烃,碳原子个数越多,耗氧量越低,且 ,故放出的热和消耗的氧都是前者多;C选项中566.0 kJ的热量是燃烧2 mol CO放出的热;D选项中人类利用的能源不一定是通过化学反应获得的,如风能等。故选B。
,故放出的热和消耗的氧都是前者多;C选项中566.0 kJ的热量是燃烧2 mol CO放出的热;D选项中人类利用的能源不一定是通过化学反应获得的,如风能等。故选B。
猜题六 化学与贝尔化学奖
 例8.2007年诺贝尔化学奖得主――德国科学家格哈德?埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器, 可将CO、NO、NO2和碳氢化合物等转化无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
例8.2007年诺贝尔化学奖得主――德国科学家格哈德?埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器, 可将CO、NO、NO2和碳氢化合物等转化无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快CO氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C. 在铂催化下,NO、NO2可被CO还原成N2
D. 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O
解析:CO是常见的还原剂,不能将碳氢化物直接氧化,碳氢化合物可直接被空气中的氧气氧化成CO2和H2O
答案:D
猜题七 化学与“嫦娥奔月”
|