
题目列表(包括答案和解析)
 2SO3(g) △H <0。
2SO3(g) △H <0。 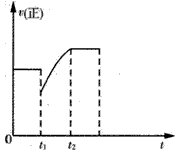
A.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动
(2)该反应在450℃时的平衡常数____500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(3)一定体积条件下,反应tmin后,SO2和SO3的物质的量浓度分别为amol·L-1和b mol·L-1 ,则SO2起始时的物质的量浓度为____mol·L-1;生成SO3的化学反应速率为___mol·L-1·min-1。
(4)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别充入2 mol SO2、1 mol O2和4 mol
SO2、2 mol O2,在相同条件下使其反应。最终达到平衡,甲、乙两容器中SO2的转化率分别为50%和α(乙),则反应的平衡常数K= ____(填写具体数据),此时α(乙)____50%(填“大于”、“小于”或“等于”)。
(8分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)2SO3(g) △H=-190 kJ·mo1-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______mol·L-1·min-1
(2)下列条件的改变对其反应速率几乎无影响的是 (选填序号)
①升高温度 ②保持体积不变,只增加氧气的质量 ③保持体积不变,充入Ne使体系压强增大 ④保持压强不变,充入Ne使容器的体积增大
(3)下列描述中能说明上述(1)反应已达平衡的是 (选填序号)
①v(O2)正=2v(SO3)逆 ②SO2、O2 、SO3的浓度之比为2:1:2
③单位时间内生成2nmolSO2的同时生成2n mol SO3
④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化 ⑥容器中气体压强不随时间而变化
(4)在相同条件下发生上述反应,若要得到380kJ热量,则加入各物质的物质的量可能是 。
A.4 mo1SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4 mo1 O2 D.6mo1 SO2和4 mo1 O2
(8分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)
 2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=______mol·L-1·min-1
(2)下列条件的改变对其反应速率几乎无影响的是 (选填序号)
①升高温度 ②保持体积不变,只增加氧气的质量 ③保持体积不变,充入Ne使体系压强增大 ④保持压强不变,充入Ne使容器的体积增大
(3)下列描述中能说明上述(1)反应已达平衡的是 (选填序号)
①v(O2)正=2v(SO3)逆 ②SO2、O2 、SO3的浓度之比为2:1:2
③单位时间内生成2n molSO2的同时生成2n mol SO3
④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化 ⑥容器中气体压强不随时间而变化
(4)在相同条件下发生上述反应,若要得到380kJ热量,则加入各物质的物质的量可能是 。
A.4 mo1SO2和2mol O2 B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2和4 mo1 O2 D.6mo1 SO2和4 mo1 O2
(12分)硫酸在国民经济中占有极其重要的地位,下图是工业接触法制硫酸的简单流程图,试回答下列有关问题.
(1)在实际生产过程中,进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。按此密闭体系中气体的流向,则在B处流出的气体(除N2外)为 ;
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
①已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
②在400-500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ;
(4)选择适应的催化剂,是否可以提高SO2的转化率? ;是否可以增大该反应所放出的热量? (填“是” 或“否”);
(5)若用浓硫酸吸收SO3可以得到H2SO4·SO3。用1000g 98 % 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是 。
(12分)硫酸在国民经济中占有极其重要的地位,下图是工业接触法制硫酸的简单流程图,试回答下列有关问题.
(1)在实际生产过程中,进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室。按此密闭体系中气体的流向,则在B处流出的气体(除N2外)为 ;
(3)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
D
D
A
B
D
D
C
D
B
B
B
C
C
A
C
C
B
A
19.(8分)( 1 ) B D ( 2 分)
(2)一定有 NO3-、Al3+、SO42-(2分); 一定无 Fe3+、Ba2+、HCO3-(2分)
(3) Al3+ + 3 NH3?H2O = Al(OH)3↓+3NH4+ (2分)
 20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
20.(10分)(一)(1)2NH4Cl
+ Ca(OH)2 CaCl2+2NH3↑+2H2O (2分)
|