
题目列表(包括答案和解析)
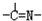 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。

(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
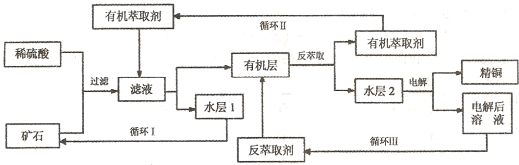
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。

已知:①Cu2O+2H+=Cu2++Cu + H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O、
、 。(写出其中2个)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个![]() 三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 。
(5)该工艺最大亮点是它符合下列原理 (填字母,下同)。
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。
A.两种方案 B.三种方案 C.四种方案 D.五种方案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com