
题目列表(包括答案和解析)
(10分)阿司匹林(乙酰水杨酸,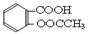 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: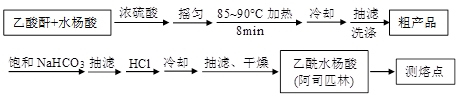
主要试剂和产品的物理常数
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示
(10分) 阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:

主要试剂和产品的物理常数
|
名 称 |
相对分子质量 |
熔点或沸点(℃) |
水 |
|
水杨酸 |
138 |
158(熔点) |
微溶 |
|
醋酸酐 |
102 |
139.4(沸点) |
反应 |
|
乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
⑴制备阿司匹林的化学方程式 。
⑵合成阿斯匹林时,如未出现结晶,可采取的措施有
_____________________________。
⑶提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是 。
⑷另一种改进的提纯方法,称为重结晶提纯法。方法如下:
 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示

①a仪器的名称 ,冷凝水的流出方向是 (填“b”或“c” )。
②重结晶提纯法所得产品的有机杂质要比原方案少的原因是
_________________________________________________。
⑸检验产品中是否含有水杨酸的化学方法是 。
⑹该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m = 2.92g ,则所得乙酰水杨酸的产率为 。
| ||
| ||

氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。在氮气流中由氧化铝与焦炭在电炉中加热制得。原料配比不当或反应不完全等因素都会造成产品中含有
碳、Al4C3或Al2O3等杂质。回答下列问题:
(1)反应Al2O3+N2+3C ![]() 2AlN+3CO中,氧化剂是
2AlN+3CO中,氧化剂是
(2)探究氮化铝与酸的反应,并检验生成产物中含有NH4+。请完成下列实验步骤。
步骤1:取少量样品于试管中,滴加稀H2SO4至溶液呈酸性
步骤2: .
(3)AlN也可以与强碱溶液反应。完成下列方程式:
AlN+NaOH+H2O= +
(4)Al4C3与水反应生成甲烷,甲烷与CuO反应的化学方程式如下:
CH4+4CuO ![]() CO2+2H2O+4Cu
CO2+2H2O+4Cu
为测定产品中有关成分的含量,所需仪器如下:
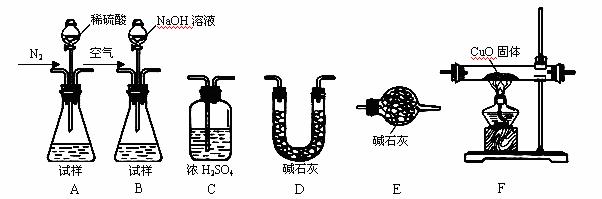
Ⅰ. 测定样品中含有少量Al4C3的含量,各装置连接的顺序为A→C→F→C→D→E。
主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→ →⑤→⑥→⑦,
操作④的目的是 。
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,
其顺序为: → → →E
若试样为mg,测得C增重n g,则AlN的质量分数是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com