
题目列表(包括答案和解析)
| A、新制氯水存放在带玻璃塞的无色细口瓶中 | B、少量白磷存放在CS2中 | C、碳酸钠固体保存在带橡胶塞的广口瓶中 | D、NaF溶液保存在带橡胶塞的细口瓶中 |

正确的存放化学药品,是化学实验基本要求之一,下列物质存放错误的是
A.漂白粉长期敞口露置于空气中 B.金属钠保存在煤油中
C.NaOH溶液试剂瓶用橡胶塞 D.氯水在棕色试剂瓶中避光存放
25、(11分)铁元素是一种重要的金属元素,铁及其化合物间可以相互转化。
(1)检验溶液中Fe3+存在的试剂是 (化学式),证明 Fe3+ 存在的现象是溶液变红。
(2) 电子工业常用30% 的FeCl3溶液腐蚀铜箔,制造印刷电路板。
![]() ①写出FeCl3溶液腐蚀铜箔的离子方程式:
①写出FeCl3溶液腐蚀铜箔的离子方程式:
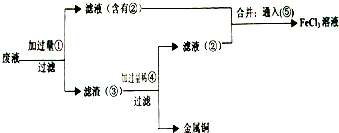
②为了从使用过的腐蚀液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A. 写出上述实验中加入或生成的有关物质的化学式:
① ② ④
B . 写出含有②的滤液与⑤反应的离子方程式
(3)实验室里配制硫酸亚铁溶液常常加入过量的铁粉防止其被氧化,纯净的氢氧化亚铁是白色
的沉淀,在空气中长时间存放最终会变为 色,有关的化学方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com