
题目列表(包括答案和解析)
(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。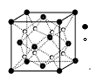
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.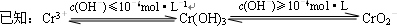 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为



 ?
?
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是 ,检验气体H已收集满的方法是 。?
(2)在实验室进行操作①时,除了使用酒精灯、铁架台、铁圈及夹持仪器外,还缺少的玻璃仪器是 ,在进行操作②时,应在HCl的气氛中加热脱水,其目的是 。?
(3)F位于元素周期表第? ?周期? ?族,写出其最高价氧化物对应的水化物的电子式? ?。写出反应A+H2O→B+H的化学方程式 。?
(4)某学生设计如图15-38装置,将产生的气体H通入硫酸铜溶液,制得深蓝色溶液J。现有下列?试剂?:?
 ?
?
图15-38
①稀NaOH溶液 ②H2O2溶液 ?③浓氨水 ?④NH4Cl?溶液 ⑤生石灰 ?⑥消石灰 ⑦碳酸氢钠?
(Ⅰ)a中的试剂:固体X应是? ?(填序号),溶液Y应是 (填序号)。
(Ⅱ)你认为使用装置b时存在的主要缺点: (用简明文字叙述)。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com