(2010?湖北模拟)某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理.
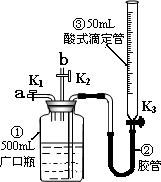
如何检查该装置气密性
关闭K1、K2,打开K3,从滴定管上口加水,没过广口瓶①中长导管口,继续加水,使广口瓶①中长导管内外出现一段液柱,停止加水,静置一段时间后,若这段液柱不变,说明装置气密性好,反之,说明装置气密性不好
关闭K1、K2,打开K3,从滴定管上口加水,没过广口瓶①中长导管口,继续加水,使广口瓶①中长导管内外出现一段液柱,停止加水,静置一段时间后,若这段液柱不变,说明装置气密性好,反之,说明装置气密性不好
.
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管中液面与①相平并记录滴定管的刻度.
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:
关闭K2,打开K1、K3,通入一定量的NO后,调整滴定管液面与①中液面相平,再次读取滴定管的刻度
关闭K2,打开K1、K3,通入一定量的NO后,调整滴定管液面与①中液面相平,再次读取滴定管的刻度
;计算出通入的NO的体积为VmL(V<50mL).
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K
1、K
3,打开K
2,从导管b缓缓通入O
2,写出通入O
2过程中发生的化学反应方程式
2NO+O2=2NO2;3NO2+H2O=2HNO3+NO
2NO+O2=2NO2;3NO2+H2O=2HNO3+NO
;
(2)继续通入O
2,打开K
3并及时调整滴定管③液面与广口瓶①中液面相平.
Ⅰ.当通入氧气的体积为
时,则广口瓶①的气体体积为
;
Ⅱ.当广口瓶①的气体体积为
,则通入氧气的体积可能为
.