
题目列表(包括答案和解析)
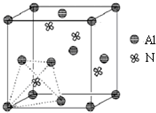
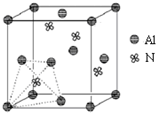 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:| 700℃ |
| 700℃ |



下图是元素周期表的框架
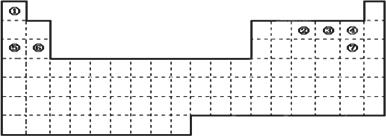
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线.
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是________(用化学式表示).
B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是________(用化学式表示).
C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是________(填写结构式).
D.在上面元素周期表中全部是金属元素的主族是________;全部是非金属元素的主族是________(填写字母a、b、c、d).
a.ⅠA族
b.ⅡA族
c.ⅥA族
d.ⅦA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式________;
(4)请写出仅用①②④三种元素形成离子化合物的电子式________.若用球棍模型表示①和③形成的化合物的分子结构,应该是________.

(5)在120℃下1 g①的单质在足量③的单质中完全燃烧,放出的热量为a kJ;请写出此条件下①的单质燃烧的热化学方程式________;
①、③两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电.
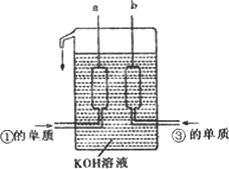
请回答:b是电池的________极;a电极上的电极反应式是________.
| |||||||||||||||


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com