
题目列表(包括答案和解析)
已知A、B、C、D、E、F六种元素的原子序数依次递增, A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;A、E的原子序数相差10,F+的M层电子全充满。
请回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)C的基态原子的外围电子排布式为 ,周期表中F
属于 区。
(2)C、D、E三元素的电负性由大到小的顺序为: ,简单离子半径由大到小的顺序为: 。
(3)BD分子中,B原子与D原子都达到8电子稳定结构,则BD的电子式是 ;
(4)BD2与EDA反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是: 。
 (5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(6)右图分别是E和F的晶胞。晶体中E和F的配位数之比为 。
(7)相同条件下,V1mLBD2与V2mLCD的混合气体通过足量E2D2固体后,气体体积变为(V1+V2)/2mL(不考虑CD与E2D2的反应),则V1与V2的关系满足: 。
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |

(10分)下表为部分短周期元素化合价及相应氢化物沸点的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |


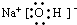
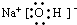
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com