
题目列表(包括答案和解析)
如图两个装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线上都通过了0.02mol e-,若不考虑溶液体积的变化,则下列叙述正确的是
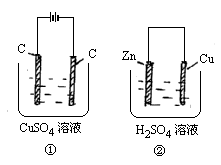
[ ]
A.产生气体体积:①=②
B.电极上析出固体质量:①<②
C.电极反应式:
①中阳极:4OH--4e-=2H2O+O2↑
②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小;②增大
已知下面三个数据:7.2×10-4mol·L-1、4.6×10-4 mol·L-1、4.9×10-10mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF,由此可判断下列叙述不正确的是
A.NaCN和HCN 物质的量比1︰1组成的混合溶液呈酸性
B.物质的量浓度均为0.1mol·l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大
C.根据上述某两个反应即可得出电离常数大小的结论
D.电离常数为:K(HCN)<K(HNO2)<K(HF)
已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF,由此可判断下列叙述不正确的是
A.NaCN和HCN 物质的量比1︰1组成的混合溶液呈酸性
B.物质的量浓度均为0.1mol·l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大
C.根据上述某两个反应即可得出电离常数大小的结论
D.电离常数为:K(HCN)<K(HNO2)<K(HF)
如下图所示两个装置中,溶液体积均为200 mL,开始时电解质溶液的浓度均为
0.1mol·L-1,工作一段时间后,测得导线上通过0.02 mol电子,若不考虑盐
水解和溶液体积的变化,则下列叙述正确的是
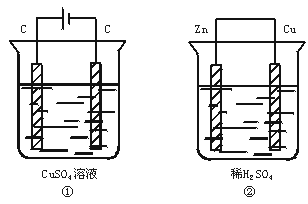
A.产生气体的体积:①>②
B.电极上析出固体的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①阳极:4OH--4e-===2H2O+O2↑
②阴极:2H++2e-===H2↑
如下图所示两个装置中,溶液体积均为200mL,开始时电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐水解和溶液体积的变化,则下列叙述正确的是
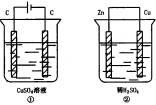
( )
A. 产生气体的体积:①>②
B. 电极上析出固体的质量:①>②
C. 溶液的PH变化:①增大,②减小
D. 电极反应式:①阳极:40H--4e—![]() 2H2O+O2②阴极:2H++2e—
2H2O+O2②阴极:2H++2e—![]() H2↑
H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com