
题目列表(包括答案和解析)



| ||
| △ |
| ||
| △ |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
A.c1=2c2 B.c2=2c1 C.c2>2c1 D.c2<2c1
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
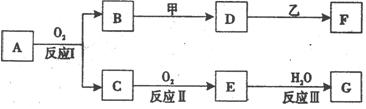
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
①反应Ⅲ的化学方程式为_______________________ _______________________。
② D与乙反应的离子方程式为________________________________ _________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
① 工业上,反应 I的化学方程式为___________________________________________
②D和乙反应的离子方程式为____________________________________ __
③ 请简述检验D溶液中阳离子的方法 。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数= (列出计算式即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com