
题目列表(包括答案和解析)
(8分)石墨的片层结构如图所示,试完成下列各题:
(1)平均________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是________。
(3) 石墨层内存在强烈的共价键,层之间存在________,所以石墨兼有原子晶体和分子晶体的特征。
(8分)石墨的片层结构如图所示,试完成下列各题:
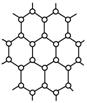
(1)平均________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是________。
(3) 石墨层内存在强烈的共价键,层之间存在________,所以石墨兼有原子晶体和分子晶体的特征。
(8分)石墨的片层结构如图所示,试完成下列各题: 
(1)平均________个碳原子构成一个正六边形。
(2)石墨晶体每一层内碳原子数与C—C化学键之比是________。
(3) 石墨层内存在强烈的共价键,层之间存在________,所以石墨兼有原子晶体和分子晶体的特征。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com