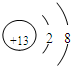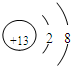现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| X |
最外层电子数是次外层电子数的3倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是
O3
O3
,元素Z的离子结构示意图为
.
(2)元素Y与氢元素形成一种离子YH
4+,请写出检验溶液中存在该离子的实验操作、现象和结论
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.
(4)元素X与元素Y相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这一事实的是
a,b,c
a,b,c
.
a.Y的氢化物可在纯X
2中燃烧生成X的氢化物和Y
2b. X的单质比Y的单质更容易与H
2 化合
c.X与Y形成的化合物中Y元素呈正价态.