
题目列表(包括答案和解析)
(12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:

(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。

A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体[来源:学*科*网]
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
(12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
(12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题: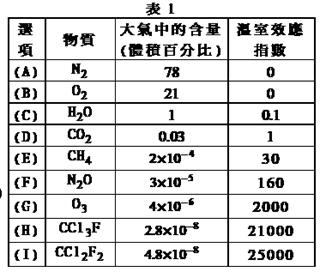
(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手 性异构
性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体[来源:学*科*网]
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
材料一:向可溶性铝盐溶液中加入氨水,会生成白色的胶状氢氧化铝沉淀,该沉淀既可溶于强酸之中,又可溶于强碱之中,因此是一种两性氢氧化物。有人认为,氢氧化铝之所以具有两性,原因是在水中存在下列酸式电离和碱式电离的有关平衡:
H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。
Al3++3OH-。
材料二:在共价键中有一种价键与一般的形成方式不同,即一方(设为A方)提供两个电子,另一方(设为B方)具有接受两个电子的空轨道,从而形成如下一种特殊化学键:A→B。这样的共价键叫做配位键。如![]() 和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即
和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即

同共价键一样,配位键可以存在于分子之中(如H2SO4、AlCl3等),也可以存在于离子之中(如![]() )。
)。

材料三:已知气态氯化铝分子以双聚形式存在,其中Al-Cl键为共价键,其结构式如上图中间结构所示。图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。
(1)通过对有关信息的学习,你对于硼酸只是一元酸是怎样认识的?
你可以通过硼酸在水溶液中的电离平衡,来解释它只是一元酸的原因。请写出下面方程式右端的两种离子的表达式:

(2)你对于材料一中氢氧化铝的有关电离方程式是怎样认识的?你完全认可吗?如果不认可,请你写出你认为的铝酸的电离方程式:________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com