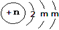(2011?福建模拟)在实验室中,某研究性学习小组利用下列装置制备漂白粉,并进行有关实验探究
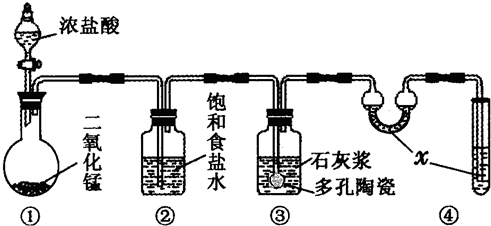
(1)装置④中的x试剂为
NaOH溶液
NaOH溶液
.
(2)装置③中发生反应的化学方程式为
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.该反应是放热反应,反应温度较高时有副反应发生.改进该实验装置以减少副反应发生的方法是
将装置③置于冷水浴中进行实验
将装置③置于冷水浴中进行实验
.
[探究一]测定漂白粉有效成分的质量分数
称取1.000g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000mol?L
-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3ClO
-+I
-=3Cl
-+IO
3- IO
3-+5I
-+3H
2O=6OH
-+3I
2实验测得数据如下表所示.
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
(3)该漂白粉中有效成分的质量分数为
42.9%
42.9%
.若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将
偏低
偏低
(填“偏高”、“偏低”或“无影响”)
[探究二]研究漂白粉用于鱼塘消毒过程中有效氯含量的变化规律研究性学习小组模拟鱼塘环境,进行有关实验.
(4)研究不同的pH对漂白粉有效氯含量的影响,结果如图所示.从图中可得到的有关结论是
pH越小,漂白粉有效氯衰减速率越快
pH越小,漂白粉有效氯衰减速率越快
(写出其中一个).
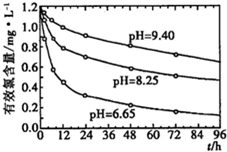
(5)为研究温度对漂白粉有效氯含量的影响,请简述你的实验设计方案:
在浓度、pH均相同的条件下,测定不同温度下.不同时间的漂白粉有效氯含量
在浓度、pH均相同的条件下,测定不同温度下.不同时间的漂白粉有效氯含量
.

 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示). (2012?福建)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
(2012?福建)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( ) (2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应:
(2011?福建模拟)甲是一元强碱,其阴、阳离子所含电子总数相等.在溶液中能发生下列反应: