
题目列表(包括答案和解析)
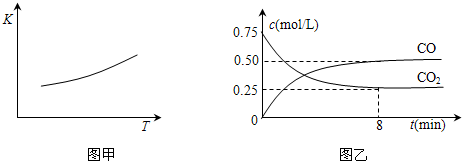
| 电解 |
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
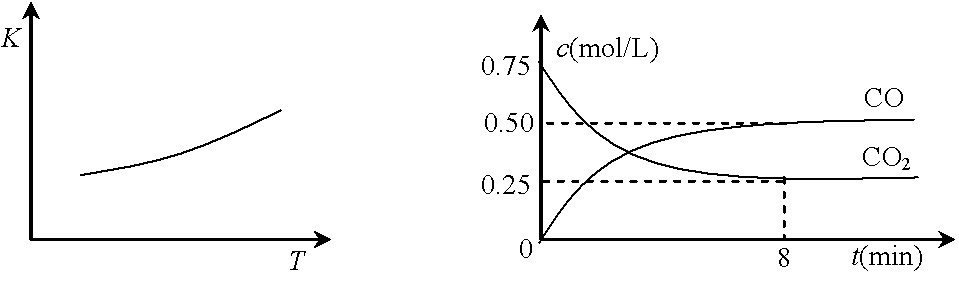
图甲 图乙
⑴该反应的平衡常数表达式K= ▲ 。
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。
8分钟内,CO的平均反应速率v(CO)= ▲ mol/(L·min)。
⑶下列措施中能使平衡时c(CO)/c(CO2)增大的是 ▲ (填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
⑷铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 ▲ 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化纳和水,该反应的离子方程式为 ▲ 。
|
![]() KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
|
| 熔点℃ | 沸点℃ | 密度(g/cm3) |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
|
![]() KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
|
| 熔点℃ | 沸点℃ | 密度(g/cm3) |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
|
 KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
|
|
熔点℃ |
沸点℃ |
密度(g/cm3) |
|
Na |
97.8 |
882.9 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com