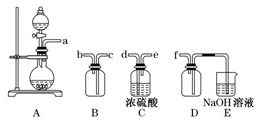
(2012?闵行区二模)工业上由氯气与消石灰反应制各漂粉精,其化学式可以用xCa(ClO)
2?yCaCl
2?zCa(OH)
2(x、y、z为简单整数)来表示.某兴趣小组同学对漂粉精进行定性、定量探究如下:
(1)证明漂粉精中含有CaCl
2①向漂粉精固体中滴加足量浓硫酸,观察到黄绿色气体生成.写出生成黄绿色气体的化学反应方程式
Ca(C1O)2+CaCl2+4H2SO4(浓)=2Ca(HSO4)2+2C12↑+2H2O;
(或Ca(C1O)2+CaCl2+2H2SO4(浓)=2CaSO4+2C12↑+2H2O);
Ca(C1O)2+CaCl2+4H2SO4(浓)=2Ca(HSO4)2+2C12↑+2H2O;
(或Ca(C1O)2+CaCl2+2H2SO4(浓)=2CaSO4+2C12↑+2H2O);
.
②将生成的黄绿色气体缓缓通过足量碱石灰,碱石灰增重,并收集到无色气体.推测过程①中生成气体除Cl
2外,还可能含有
HCl
HCl
、
O2
O2
(填化学式),写出检验收集到的无色气体的方法
将带火星的木条伸人集气瓶中,若木条复燃证明是氧气
将带火星的木条伸人集气瓶中,若木条复燃证明是氧气
.
(2)证明漂粉精中含有Ca(OH)
2[已知电离常数:K
i1(H
2CO
3)>K
i(HClO)>K
i2(H
2CO
3)]
①将少量漂粉精溶于水后,测定其pH值为12.3.采用的测定方法可能是
c
c
(选填答案编号).
a.使用广泛pH试纸 b.使用精密pH试纸
c.使用pH计 d.以酚酞为指示剂进行酸碱中和滴定
②下列探究步骤的设计中,对证明该结论无意义的是
a
a
(选填答案编号).
a.向漂粉精溶液中通入适量CO
2,测定溶液的pH值变化
b.向漂粉精溶液中加入适量碳酸氢钠固体,测定溶液pH值变化
c.向漂粉精溶液中加入适量亚硫酸钠固体,测定溶液pH值变化
测定漂粉精中有效成分的含量
【实验原理】ClO
-+2I
-+2H
+→Cl
-+I
2+H
2O;I
2+2S
2O
32-→2I
-+S
4O
62-【实验步骤】
i.称取7.740g漂粉精固体,溶解,配成250mL溶液;
ii.量取该溶液5.00mL于锥形瓶,加入过量KI溶液、酸化,并加入指示剂;
iii.用0.100mol/L Na
2S
2O
3标准溶液滴定至终点,记录始末读数;
iv.重复ii、iii操作,记录始末读数.
(3)该实验中要使用的定量仪器除电子天平外还有
滴定管、250mL容量瓶
滴定管、250mL容量瓶
(写名称).
(4)步骤ii中加入的指示剂为
淀粉
淀粉
(写名称),当观察到
溶液由蓝色变为无色,且半分钟内不变化
溶液由蓝色变为无色,且半分钟内不变化
时,达到滴定终点.
(5)实验数据如下:
若理论上滴定时消耗标准溶液27.00mL,则相对误差为
-0.173%
-0.173%
(保留3位有效数字).
(6)该漂粉精中Ca(ClO)
2的质量分数为
62.4%
62.4%
(保留3位有效数字).
| 实验编号 |
1 |
2 |
3 |
| 消耗Na2S2O3体积/mL |
26.90 |
27.00 |
26.96 |