
题目列表(包括答案和解析)

| 实验编号 | 温度 | 大理石 | 盐酸浓度 | 实验探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | ⅰ实验①和②探究浓度对反应快慢的影响. ⅱ实验②和 ⅲ实验①和③探究大理石粗细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | ||
| ③ | 细颗粒 | 5% | ||
| ④ | 40℃ | 10% |
| 方案 | 填是否合理 | 说明理由(写化学方程式) |
| 测溶液的pH是否小于7 | 合理 | 氯化钙是中性溶液,而盐酸呈酸性. |
| 滴加硝酸银溶液观察是否有白色沉淀生成 | ||
| 加铁粉观察是否有气泡 |
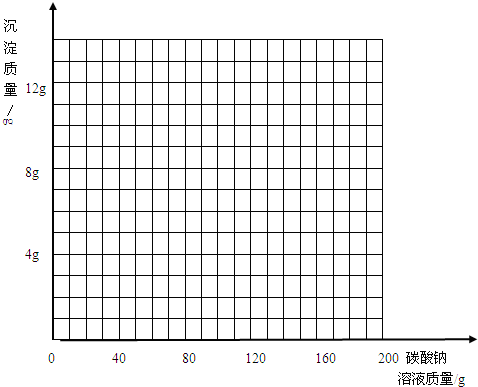
| 加入碳酸钠溶液的质量/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| 生成沉淀的质量/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
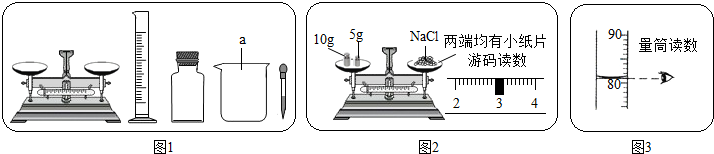
| 6.55g |
| 39.6g |
| 6.55g |
| 39.6g |
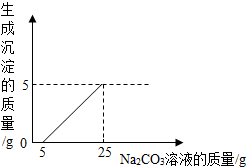 某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数.他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com