
题目列表(包括答案和解析)
(17分)H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应: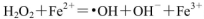
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量
143,H-O为463。则 .
.
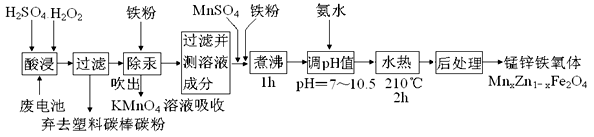

氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用图Ⅰ所示的装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O====NaAlO2+NH3↑,已知NH3极易溶解于水,Al在常温下能与NaOH溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
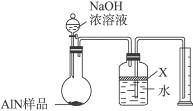
图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷 B.酒精 C.植物油 D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。
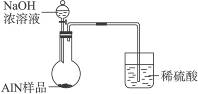
图Ⅱ
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验),

查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1)??????? 。
(2)D装置的作用是??????? 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是?????? 。
A.亚硝酸盐是还原剂????????????? ????????????? ????????????? ? B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+????????????? ????????????? ????????????? ? D.亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是?????????
A .测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法??
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式??????????????????????????????????????????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com