
题目列表(包括答案和解析)
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量CaCl2溶液. | 有白色沉淀生成 | 生成白色沉淀的化学方程式为: ______. |
| ②过滤,向滤液中滴加无色酚酞溶液. | ______ | 通过实验及分析,样品中只含有: 碳酸钠和碳酸钙. |

| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量CaCl2溶液. | 有白色沉淀生成 |
生成白色沉淀的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl . |
| ②过滤,向滤液中滴加无色酚酞溶液. | 不变红色 不变红色 |
通过实验及分析,样品中只含有: 碳酸钠和碳酸钙. |

 人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
| ||
| ||
 人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.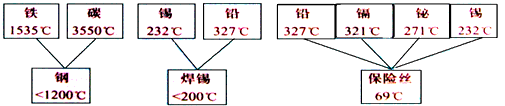


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com