
题目列表(包括答案和解析)
(16分)向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1 阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
则K1= (保留两位小数),
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
【解析】(1)化学反应速率通常用单位时间内浓度的变化量来表示。根据图像I可知在15min内C的浓度变化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率为
(2)由图像Ⅱ可知,在t4~t5阶段反应速率减小,但平衡不移动,所以改变的条件不可能是温度和浓度,由于在t3~t4阶段为使用催化剂,所以该阶段只是降低压强。这说明改变压强平衡不移动,因此反应前后体积是不变的。根据图像I可知A是反应物,C是生成物,二者的变化量之比是2︰3,所以要使反应前后体积不变,B只是反应物,及反应的方程式为2A+B3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为
![]() 。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
(3)根据题意科判断,每消耗0.01molA,反应就吸收能量akJ,所以反应的热化学方程式为2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因为容器容积不变(容器容积是2L),所以要使平衡等效,则起始物质的物质的量是相等的。根据题意可知起始时AB的物质的量分别为2.4mol和1.2mol,则把cmol的C转化为AB,则AB的物质的量(mol)分别是a+2c/3、b+c/3,所以关系式必须满足a+2c/3=2.4、b+c/3=1.2.
(16分) 向一定体积的密闭器中加入2 mol A、0.6 mo1 C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图(Ⅰ)所示,其中t0~t1 阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.

请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示反应速率为 。
(2) t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 ,各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
t5~t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),
K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接).
(3) t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为 .
【解析】(1)化学反应速率通常用单位时间内浓度的变化量来表示。根据图像I可知在15min内C的浓度变化量是0.6mol/L-0.3mol/L=0.3mol/L,所以速率为
(2)由图像Ⅱ可知,在t4~t5阶段反应速率减小,但平衡不移动,所以改变的条件不可能是温度和浓度,由于在t3~t4阶段为使用催化剂,所以该阶段只是降低压强。这说明改变压强平衡不移动,因此反应前后体积是不变的。根据图像I可知A是反应物,C是生成物,二者的变化量之比是2︰3,所以要使反应前后体积不变,B只是反应物,及反应的方程式为2A+B 3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为
3C。C的浓度增加了0.3mol/L,则B的浓度减少了0.1mol/L,所以B的起始浓度是0.4mol/L+0.1mol/L=0.5mol/L。在t1~t2阶段平衡是ABC的浓度(mol/L)分别为0.8、0.4、0.6,所以平衡常数为 。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
。因为平衡常数只与温度有关,根据图像可知在t5~t6阶段,正逆反应速率同时增大,但平衡向正反应方向移动,因为该条件只能是温度且是升高温度,所以反应是吸热反应,因此K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5。
(3)根据题意科判断,每消耗0.01molA,反应就吸收能量akJ,所以反应的热化学方程式为2A(g)+B(g)⇋3C(g) △H=+200kJ/mol。
(4)因为容器容积不变(容器容积是2L),所以要使平衡等效,则起始物质的物质的量是相等的。根据题意可知起始时AB的物质的量分别为2.4mol和1.2mol,则把cmol的C转化为AB,则AB的物质的量(mol)分别是a+2c/3、b+c/3,所以关系式必须满足a+2c/3=2.4、b+c/3=1.2.
18.(14分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+ O2(g)=CO2(g)的△H=
kJ·mol-1
O2(g)=CO2(g)的△H=
kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为
,平衡时H2的转化率为
%,该反应的平衡常数K=
(mol·L-1)-2.
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为
,平衡时H2的转化率为
%,该反应的平衡常数K=
(mol·L-1)-2.
(4)在固定体积的密闭容器中.1.0×103kPa时反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0的平衡常数K与温度T的关系如下表:
|
T/K |
298 |
398 |
498 |
|
平衡常数K |
51 |
K1 |
K2 |
则K1 K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为I:3:2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
18.(14分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+O2(g)=2 NO(g) △H=+180kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746kJ·mol-1
则反应CO(g)+O2(g)=CO2(g)的△H= kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为 ,平衡时H2的转化率为 %,该反应的平衡常数K= (mol·L-1)-2.
(4)在固定体积的密闭容器中.1.0×103kPa时反应N2(g)+3H2(g)2NH3(g)
△H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
则K1 K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为I:3:2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
18.(14分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过 程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
程中能量变化示意图,写出NO2和CO反应的热化学方程式 。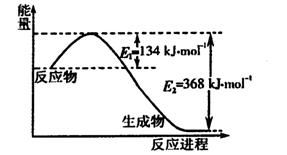
(2)已知:N2(g)+O2(g)="2" NO(g)△H="+180" kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H="-746" kJ·mol-1
则反应CO(g)+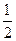 O2(g)=CO2(g)的△H= kJ·mol-1
O2(g)=CO2(g)的△H= kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)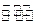 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为  ,平衡时H2的转化率为 %,该反应的平衡常数K= (mol·L-1)-2.
,平衡时H2的转化率为 %,该反应的平衡常数K= (mol·L-1)-2.
(4)在固定体积的密闭容器中.1.0×103kPa时反应N2(g)+3H2(g)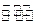 2NH3(g)
2NH3(g)
△H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
 1 K2(填写“>”、“=”或“<”)
1 K2(填写“>”、“=”或“<”)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com