
题目列表(包括答案和解析)
(14分)2010年在我国北方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为  ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=_____,该融雪剂的化学式为_______。
(2)Z、W元素名称分别为_______、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:X2+[ ]2-
]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为: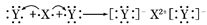
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是
。
(14分)2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)  2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应的平衡常数表达式 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)在一定条件下,也可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。则2 molCH4与足量H2O(g)反应最多可生成_______mol H2,写出该反应的化学方程式_________________________________________________。
(5)上述方法制得的H2可以和CO在一定条件下合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(14分)2010年在我国北方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为  ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=_____,该融雪剂的化学式为_______。
(2)Z、W元素名称分别为_______、_______。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:X2+[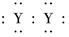 ]2-
]2-
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程为:
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是
。
(08年北京卷)(14分)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)______________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是______。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)___________________________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是__________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示)__________。
(08年全国卷)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5中化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
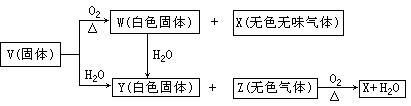
(1)5种化合物分别是V ______ 、W______ 、X ______ 、Y_____ 、Z___ ;(填化学式)
(2)由上述5中化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是________ ;
(3)V的电子式是 ____ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com