(2008?黄冈)在九年级化学复习课中,某化学学习小组对部分化学知识内容进行总结,请你一起参加总结:
(1)我们学习了盐,日常生活中所说的盐指
NaCl
NaCl
(填化学式),它在人体内的作用有①维持人体体液,促进细胞内外物质交换,②
促生盐酸,帮助消化,增进食欲
促生盐酸,帮助消化,增进食欲
.
(2)精盐由粗盐提纯得到,其操作步骤是①
溶解
溶解
②
过滤
过滤
③
蒸发
蒸发
其中第③步二次用到玻璃棒,它所取到的作用分别是
搅拌防止液滴飞溅
搅拌防止液滴飞溅
和转移固体.
(3)我们还认识另外几种重要的盐如:碳酸钙和碳酸钠等,其中属于大理石和石灰石的主要成分的是
CaCO3
CaCO3
.侯氏制碱法中的“碱”实际上是
Na2CO3
Na2CO3
物质(填化学式),由于这两种盐能与稀盐酸发生反应产生二氧化碳,所以可用此方法检验CO
32-的存在,其原理是(用化学方程式表示).
CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)
CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2CO3+2HCl=2NaCl+H2O+CO2↑)
.

 “三酸两碱”是几种重要的天机化工原料,如图是它们与其他物质间相互转化的关系.已知:
“三酸两碱”是几种重要的天机化工原料,如图是它们与其他物质间相互转化的关系.已知:
 沉淀完全溶解,并产生二氧化碳,
沉淀完全溶解,并产生二氧化碳, 沉淀不溶解
沉淀不溶解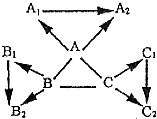 “三酸两碱”是几种重要的天机化工原料,如图是它们与其他物质间相互转化的关系.已知:
“三酸两碱”是几种重要的天机化工原料,如图是它们与其他物质间相互转化的关系.已知: