
题目列表(包括答案和解析)
甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08 mg?m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
【测定原理】: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸
4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
【测定装置】:部分装置如下图所示

【测定步骤】:
(1)用 量取5.00 mL 1.00×10-3 mol?L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释备用。
(2)将1.00×10-3 mol?L-1的草酸标准溶液置于酸式滴定管中备用;
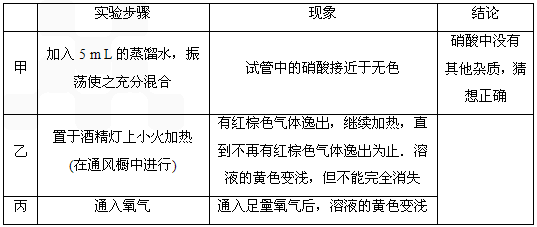
(3)打开a,关闭b, 用注射器抽取100 mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次;
(4)将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积;
(5)再重复实验2次,(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
【交流讨论】:
(1)计算该居室内空气中甲醛的浓度为 mg ?m-3,该居室的甲醛 (填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设: 、
。 (至少答出2种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
![]() 实验中无需用草酸标准液滴定,可多次直接抽取室内空气,再压送到洗气瓶中,直至
实验中无需用草酸标准液滴定,可多次直接抽取室内空气,再压送到洗气瓶中,直至
;
②实验装置应加以改进
可将插入KMnO4溶液的导管下端改成具有多孔的球泡(右图),有利于提高实验的准确度,其理由是 。
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为C+H2O![]() CO+H2.C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
CO+H2.C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)![]() CO2(g);ΔH1=-393.5 kJ·mol-1,
CO2(g);ΔH1=-393.5 kJ·mol-1,
H2(g)+![]() O2(g)
O2(g)![]() H2O(g);ΔH2=-242.0 kJ·mol-1,
H2O(g);ΔH2=-242.0 kJ·mol-1,
CO(g)+![]() O2(g)
O2(g)![]() CO2(g);ΔH3=-283.0 kJ·mol-1.
CO2(g);ΔH3=-283.0 kJ·mol-1.
甲同学根据1 mol CO(g)和1 mol H2(g)燃烧放出的热量总和比1 mol C(s)燃烧放出的热量多,认为:“煤炭燃烧时加少量的水,可以使煤炭燃烧放出更多的热量.”乙同学根据盖斯定律作出了下列循环图:
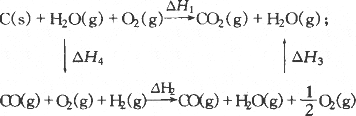
乙同学认为:“将煤转化为水煤气再燃烧放出的热量与直接燃烧煤放出的热量一样,而将煤转化为水煤气会增加消耗,因此,将煤转化为水煤气得不偿失.”你认为他们的观点对吗?将你的想法与同学交流讨论.
某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究.
[探究目的]
分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
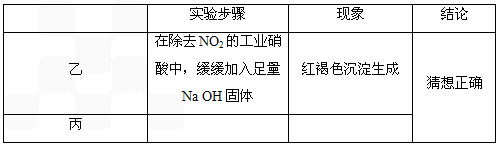
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(
稀)=Fe(NO3)3+NO↑+2H2O8Fe+30HNO3(
更稀)=8Fe(NO3)3+3 NH4 NO3+9H2O④3Fe3O4+28HNO3(
稀)=9Fe(NO3)3+NO↑+14H2O[实验探究]
Ⅰ.定性检验

(1)实验③发生的反应的离子方程式为________.
(2)上述实验说明黑色粉末X中含有________.
Ⅱ.定量测定
根据下图所示的实验方案进行实验并记录数据:

(1)操作Z的名称是________.
(2)通过以上数据,得出13.12 g黑色粉末X中各成分的物质的量为________.
[交流讨论]
在实验过程中,发现在溶液Y中滴加过量NaOH溶液时有刺激性气味气体生成.为了确定溶液Y中各离子浓度,甲同学重复上述实验.在步骤①中共收集到标准状况下896 mL的气体,经分析其中只含有NO;测得溶液Y中c(H+)
=0.5 mol/L.
通过计算可知,溶液Y中c(Fe3+)=________mol/L,c(NH
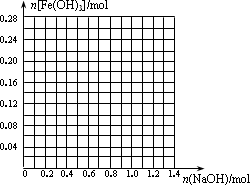
请画出在200 mL溶液Y中加入NaOH物质的量与生成的Fe(OH)3沉淀物质的量的关系曲线.
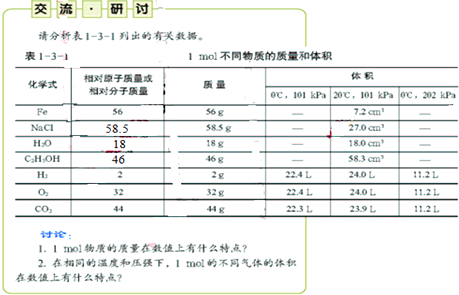
| A、1mol物质的质量在数值上等于其相对原子质量或相对分子质量 | B、相同的温度和压强下,1mol任何气体体积在数值上近似相等 | C、1mol不同物质,相同温度下,体积与压强成正比 | D、相同压强下,1mol相同的气体,温度越高,体积越大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com