
题目列表(包括答案和解析)
A、NH4Cl B、CaCO3 C、SO2 D、蔗糖 E、NaCl溶液
F、NaHCO3 G、NH3·H2O H、液氯 I、铜
(2)(2分)0.3 mol B2H6(气态高能燃料)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 的热量,写出该反应的热化学方程式
。
(3)(2分)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH3=-285.8 kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是![]() 。
。
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是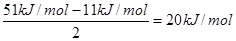 。
。
| 实验编号 | C物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| m | 0.1 | 0.1 | pH=9 |
| n | 0.2 | 0.1 | pH<7 |
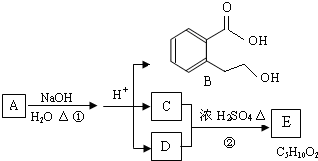
28.下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
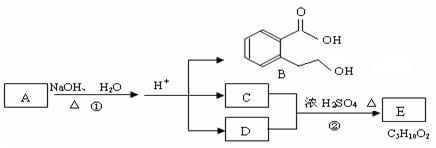
根据上图回答问题:
(1)C分子中的官能团名称是 ______________;化合物B不能发生的反应是 (填字母序号):
a 加成反应 b取代反应 c消去反应 d酯化反应 e水解反应 f 置换反应
(2)反应②的化学方程式是___________ _。
(3)试分析反应②加热的原因。
Ⅰ、 。;
Ⅱ、 。。
(4)A的结构简式是 __________________ 。
(5)同时符合下列三个条件的B的同分异构体的数目有 个。
Ⅰ.含有间二取代苯环结构 Ⅱ.属于非芳香酸酯 Ⅲ.与 FeCl3 溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 。
(6)常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | C物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| m | 0.1 | 0.1 | pH=9 |
| n | 0.2 | 0.1 | pH<7 |
从m组情况分析,所得混合溶液中由水电离出的c(OH-)= mol·L-1。
n组混合溶液中离子浓度由大到小的顺序是 ___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com