
题目列表(包括答案和解析)
(6分)在加热条件下,用MnO2与足量浓盐酸反应,制得氯气0.56L(标准状况)。
MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O
问:(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
已知烧瓶内发生的是制取氯气的反应:MnO2+4HCl(浓) 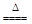 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O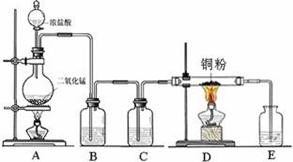
(1)(2分)用双线桥法标出烧瓶内发生反应的电子转移方向和数目
MnO2+4HCl(浓) 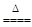 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)B处盛有饱和食盐水,其作用是 。
(3)C处盛放的是下列试剂中的_______(填序号);E处盛放的是下列试剂中的______(填序号),发生反应的离子方程式为 。
a、水 b、氢氧化钠溶液 c、浓硫酸 d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是__________________________________。
Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓)  MnCl2+
MnCl2+  Cl2↑+ 2H2O,
Cl2↑+ 2H2O,
(1)用双线桥标出电子转移方向和数目。(在答题卷上标)
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为 ,被氧化HCl的质量为 。
Ⅱ、科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物。通过以上信息填空:
(1)维生素C具有 (填氧化性或还原性)。
(2)上述过程中+5价砷类物质作为 (填氧化剂或还原剂),+5价砷元素发生 反应(填氧化或还原);2mol +5价砷完全转化为 +3价砷,共转移 个电子(用NA表示阿伏加德罗常数)。
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
已知二氧化锰固体与浓盐酸共热可以生成氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,现有4.35g二氧化锰固体与足量的浓盐酸充分反应,转移电子的物质的量与被氧化的HCl的物质的量分别为
MnCl2+Cl2↑+2H2O,现有4.35g二氧化锰固体与足量的浓盐酸充分反应,转移电子的物质的量与被氧化的HCl的物质的量分别为
A.0.1mol;0.2mol B.0.2mol;0.1mol
C.0.2mol;0.2mol D.0.1mol;0.1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com