
题目列表(包括答案和解析)
(10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:

Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比_______;
Ⅱ.(B处溶液中存在的浓度最大的离子是_____________(填离子符号);
Ⅲ.(铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++AlO2-+H2O=Al(OH)3↓+NH3↑。
试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少。请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(3)向含有0.01mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
向体积为0.5L的
AlCl3溶液中逐
滴加入某
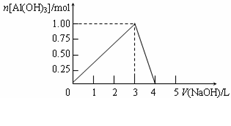
浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5L
D.当NaOH溶液体积为4.0L时,得到的溶液中Na+、Cl-浓度相等
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0 mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5 L
D.当V(NaOHaq)=4.0 L时,得到的溶液中
Na+、Cl-浓度相等
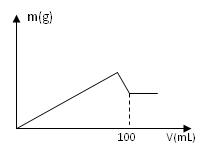
有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。
求:(1)原NaOH溶液的质量分数为 。
(2)AlCl3和MgCl2的物质的量分别是多少?
(3)另取64.70克该混合物溶于水,要使沉淀质量最大,需要加入8.00mol/L的氢氧化钠溶液多少毫升?
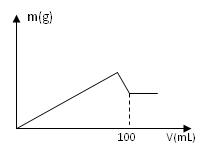
有AlCl3和MgCl2的固体混合物,取一定量的该混合物加水溶解配成溶液,实验测知Cl-的物质的量为0.70摩尔,如向该混合溶液中逐滴加入8.00mol/L的氢氧化钠溶液(密度为1.27g/mL),加入氢氧化钠溶液的体积(V)和沉淀的质量(m)有右图所示的关系。
求:(1)原NaOH溶液的质量分数为 。
(2)AlCl3和MgCl2的物质的量分别是多少?
(3)另取64.70克该混合物溶于水,要使沉淀质量最大,需要加入8.00mol/L的氢氧化钠溶液多少毫升?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com