
题目列表(包括答案和解析)
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氧化铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是??????? 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。你认为这种说法合理吗???? 。简述你的理由(不需写出反应的化学方程式):?????????????? 。
(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是??? ,写出发生的氧化还原反应的离子方程式:????? 。
【探究延伸】
(4)经过实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经过查阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
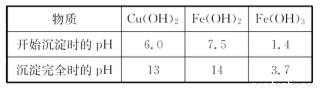
实验小组设汁如下实验方案:
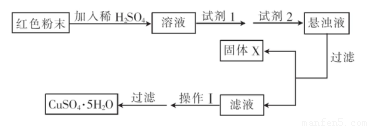
①试剂1为??? .试剂2为??????? . (填字母)
A.氯水????? B.H2O2???? C.NaOH??? D.CuO
②固体X的化学式为???????? 。
③操作II为?????????????? 。
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
|
实验步骤 (不要求写具体操作过程,仪器任选) |
预期的实验现象及结论 |
|
取适量的白色固体置于试管中,………… |
|
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:
二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设 不成立。
(2)若假设二成立,反应的化学方程式是 。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
| 实验步骤 (不要求写具体操作过程,仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,………… | |
| 实验步骤 (不要求写具体操作过程,仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,………… | |
I某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cr、OH-、HCO![]() 、NO
、NO![]() 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有 ,
一定不会含有大量的 。
(2)该溶液与Al2O3反应后有【Al(OH)4】生成,则原溶液中一定含有 ,可能含有
大量的 。
(3)写出该溶液与Al2O3反应生成【Al(OH)4】的离子方程式 。
Ⅱ. 研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是
。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃~1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为 ,可以得出的结论是
。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是 ,B中发生反应的化学方
程式为 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com