
题目列表(包括答案和解析)
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅰ:在2支试管中分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表1:
|
试 管 |
未加MnSO4的试管 |
加有MnSO4的试管 |
|
褪色时间 |
30 s |
2 s |
[表1]
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
|
试 管 |
未滴加稀硫酸的试管 |
滴加了稀硫酸的试管 |
|
褪色时间 |
100 s |
90 s |
[表2]
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
|
试 管 |
滴入10滴稀硫酸的试管 |
加入1 mL稀硫酸的试管 |
加入2 mL稀硫酸的试管 |
|
褪色时间 |
70 s |
100 s |
120 s |
[表3]
(1)实验Ⅰ得出的结论是_____。
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。[来
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利[
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
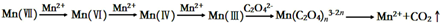
上述实验中,实验_____可证明这个历程是可信的。
| 高温 |
| A、形成1molSO2(g)中的化学键所释放的总能量大于断裂1molS(s)和1molO2(g)中的化学键所吸收的总能量 | B、1molS(g)充分燃烧生成SO2,放出热量大于297.23kJ | C、1molS(g)充分燃烧生成SO2(g),放出热量小于297.23kJ | D、在25℃,101kPa下,燃烧1molS放出的热量为297.23kJ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com