
题目列表(包括答案和解析)

(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中总反应的离子方程式为_______________,在X极附近观察到的实验现象是_______________。检验Y电极反应产物的方法是_______________。
(2)若想用电解实验制得白色纯净的Fe(OH)2沉淀,a仍是饱和NaCl溶液,则Y电极反应式为 _______________,往U型管添加完饱和NaCl溶液后需加入少量苯,苯的作用是_______________。
(3)若想用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_______________,Y电极反应式为___________________。
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:

已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用 代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
|
物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
|
KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
|
K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
|
K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
|
KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为① 、② 。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为 (设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将: (填“偏高”、“偏低”或“不变”)。
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下: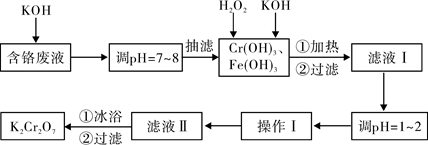
已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有 。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用 代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为 。
(3)滤液Ⅰ酸化前,进行加热的目的是 。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是 。
(4)下表是相关物质的溶解度数据:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
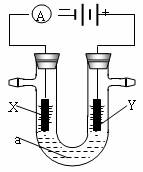
(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中总反应的离子方程式为 ,在X极附近观察到的实验现象是 。检验Y电极反应产物的方法是 。
(2)若想用电解实验制得白色纯净的Fe(OH)2沉淀,a仍是饱和NaCl溶液,则Y电极反应式为 ,往U型管添加完饱和NaCl溶液后需加入少量苯,苯的作用是 。
(3)若想用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
, Y电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com