
题目列表(包括答案和解析)
 21、生产、生活中处处有化学.
21、生产、生活中处处有化学.


| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- 可能性一:Ba2+ 可能性二:SO42- 可能性三:Ba2+或SO42- | ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. ①取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+;若没有出现白色沉淀,则说明上述溶液中不含有Ba2+., ②取上述溶液少量于试管中,加入少量硝酸钡溶液.若出现白色沉淀,则说明上述溶液中含有SO42-;若没有出现白色沉淀,则说明上述溶液中不含有SO42-. ③取上述溶液少量于试管中,加入少量硫酸钠溶液.若出现白色沉淀,则说明上述溶液中含有Ba2+,不含有SO42-. |
在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应 ;
⑵一个有沉淀生成的反应 。
【挖掘实质】
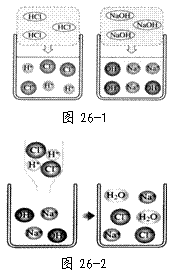
⑴图26-1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会![]() 解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是 (填离子符号)。
解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是 (填离子符号)。
⑵图26-2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为
H+ + OH- = H2O
我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质 。
【实践运用】
⑴通过上述探究发现,在溶液中H+和OH-不能大量共存,我还发现在溶液中
和 (填离子符号,下同)也不能大量共存。
⑵利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液。经测定,该溶液显酸性。则在该溶液中一定含有的离子是 。为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证。
| 溶液中可能含有的离子 | 设计实验验证(实验步骤、现象及对应的结论) |
【知识升华】
对“复分解反应发生的条件”的再探究,我发现在分析多种溶液混合后所得溶液中离子的成分时,![]() 应考虑的因素是 。
应考虑的因素是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com