合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
⑴下列措施不利于有效减少二氧化碳排放的是
。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
⑵科学家致力于二氧化碳的“组合转化”技术研究,如将CO
2和H
2以1∶4比例混合通入反应器,适当条件下反应可获得一种能源。完成以下化学方程式:CO
2+4H
2
+2H
2O。
⑶CO
2合成生产燃料甲醇(CH
3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO
2和6 mol H
2,发生:CO
2(g)+3H
2(g )

CH
3OH(g)+H
2O(g)能判断该反应已达化学反应限度标志的是
(填字母)。
A.CO
2百分含量保持不变
B.容器中H
2浓度与CO
2浓度之比为3:1
C.容器中混合气体的质量保持不变
D.CO
2生成速率与CH
3OH生成速率相等
现测得CO
2和CH
3OH(g)的浓度随时间变化如左下图所示。从反应开始到平衡,氢气的平均反应速率v(H
2)=
mol/(L·min)。
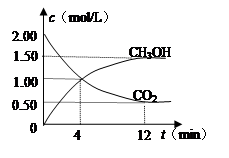
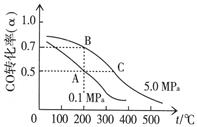
⑷CO在催化作用下也能生成甲醇:CO(g)+2H
2(g)

CH
3OH(g);已知密闭容器中充有10 mol CO与20 mol H
2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
①若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间t
A t
C(填“大于”、“小于”或“等于”)。
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为V
AL,则A、B两点时容器中,n(A)
总︰n(B)
总=
。
⑸以KOH为电解质的甲醇燃料电池总反应为:2CH
3OH+3O
2+4KOH
= 2K
2CO
3+6H
2O,通入甲醇的电极为燃料电池的负极,正极发生的电极反应式为
。

 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。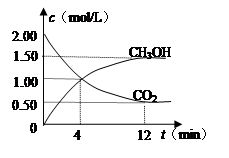
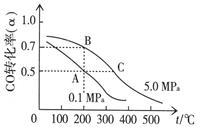
 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。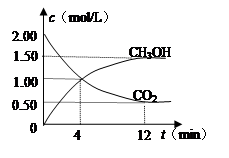

 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。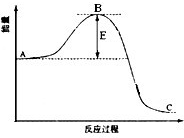 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题: 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: