
题目列表(包括答案和解析)
结合生产生活实际,举两个例子说明缓冲溶液的应用.
| ||
| ||
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| ||
| ||
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
(16分)碳和碳的化合物在生产生活实际中应用广泛。运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 ;
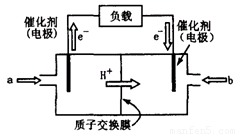
(2)上图为常用笔记本电脑所用的甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2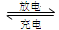 2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为
;
2CO2+4H2O。该装置放电时 (填“a”或“b”)为电池的负极,其电极反应式为
;
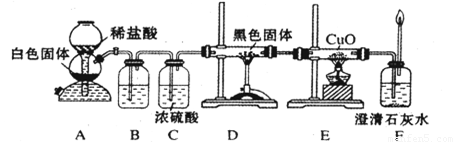
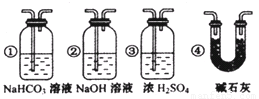
(3)CO具有还原性,某化学研究小组为证明CO具有还原性,设计了如图所示的实验装置。
已知:C + H2O CO+H2 CO + H2O
CO+H2 CO + H2O CO2 + H2 C + CO2
CO2 + H2 C + CO2 2CO
2CO
试回答下列问题:
① 装置B中最适宜的试剂是 ,必须用装置C吸收气体中的水蒸气的理由是 ;
② 根据该实验中的 现象,可证明CO具有还原性;
③ 若要根据装置F中石灰水变浑浊的现象准确确认CO具有还原性,则应在上图装置 与 之间(填字母标号)连接下图中的 装置(选填序号)。
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),得到如下三组数据:
CO2 (g) + H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com