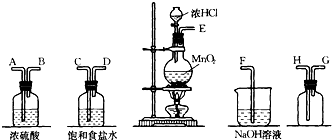
在实验室里可用图一所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
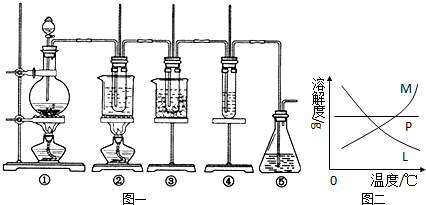
图一中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.请填写下列空白:
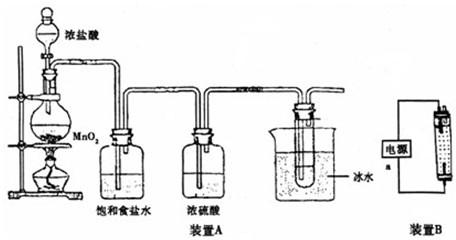
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO
2固体,其反应的化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
.
(2)如果实验室中MnO
2用完了,则下列物质可能可以用来代替MnO
2制Cl
2的是:
A、C
A、C
(已知氧化性强弱顺序为:NaBiO
3>PbO
2>MnO
2>FeCl
3).
A.NaBiO
3 B.FeCl
3 C.PbO
2(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是①
制取温度不同
制取温度不同
; ②
制取时碱的浓度也不同
制取时碱的浓度也不同
.
(4)反应完毕经冷却后,②的试管中有大量晶体析出.图二中符合该晶体溶解度曲线的是
M
M
(填写编号字母);从②的试管中分离出该晶体的方法是
过滤
过滤
(填写实验操作名称).
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性
否
否
.为什么?
石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2
石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2
.
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.所得溶液中Cl
-离子的物质的量
0.250mol
0.250mol
.

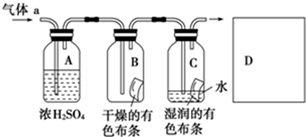 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.