
题目列表(包括答案和解析)
(本题共8分)高锰酸钾(KMnO4)是一种常用的氧化剂。
(1).有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的配平的离子方程式_____________________________。
(2).不同条件下高锰酸钾可发生如下反应:
MnO4-+5e+8H+→Mn2++4H2O
MnO4-+3e+2H2O→MnO2+4OH-
MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与 有关。
(3).高锰酸钾可代替二氧化锰用来制取Cl2,氧化剂和还原剂物质的量之比为_____________。
(4).高锰酸钾与硫化亚铁有如下反应:
10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 个。
(本题共10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:a:常见双原子单质分子中,X分子含共价键最多。
b:甲分子中含10个电子,乙分子中含有18个电子。
(1)X的结构式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备收集甲。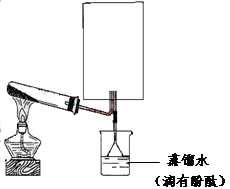
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
④写出工业制甲的化学方程式 。
实验题:(本题共9分)某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:?
| A.在250 mL的容量瓶中配制250 mL烧碱溶液; | B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂;? | C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解; | D.将物质的量浓度为cmol/L的标准盐酸溶液装入酸式滴定管。调整液面记下开始读数为V1 mL;E.在锥形瓶下垫一张白纸,滴定最后一滴至红色刚好消失 为止,半分钟后不恢复红色,记下读数V2 mL。? 为止,半分钟后不恢复红色,记下读数V2 mL。? |
 2)观察滴定管里液面的高度时应注意: 。?
2)观察滴定管里液面的高度时应注意: 。?(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:

根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: ,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
(本题共8分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以制取乙酸乙酯。回答下列问题:
(1)浓硫酸的作用是: 。
(2) 若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(3) 饱和碳酸钠溶液的主要作用是 。
(4)写出制取乙酸乙酯的化学反应方程式 。
(5) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度相等
⑥反应不再继续进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com