
题目列表(包括答案和解析)
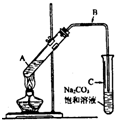 (2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究.
(2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O| 组序号 | 催化剂 | 反应现象 | C中饱和碳酸钠溶液中酯层高度 |
| ① | 2mL98%浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐渐加深,最后成黑色;酯层无气泡. | 2.10cm |
| ② | 2mL14mol?L-1硫酸 | 反应后溶液颜色呈棕色,酯层与饱和碳酸钠溶液界面清晰,无气泡. | 2.14cm |
| ③ | 2mL10mol?L-1硫酸 | 反应后溶液颜色呈无色,酯层与饱和碳酸钠溶液界面清晰,无气泡. | 2.16cm |
| ④ | 2mL7mol?L-1硫酸 | 反应后溶液颜色呈无色,酯层与饱和碳酸钠溶液有气泡. | 2.00cm |
| △ |
| △ |
(10分)8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。

请回答下列问题:
(1)试确定78℃时固体物质M的化学式: 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。

①试剂X的名称是 。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量 (填计算式) 。
(8分)碘在科研与生活中有重要的应用。某兴趣小组用0.50mol·L-1KI 、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知S2O82—+2I—=2SO42—+I2 (慢) I2 +2S2O32—=2I—+S4O62—(快)
(1)向KI 、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中 (写离子符号)耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为n(S2O32—)︰n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | VX | 4.0 | 4.0 | 2.0 |
(6分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
(2)滴定结果如下表所示:
|
滴定 次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH  M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
M(OH)x |
Ksp |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是 。
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 。
(6)试写出⑥的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com