某同学想通过如图装置实验、探究SO
2与Na
2O
2反应的产物.(夹持装置已略去,装置的气密性良好)
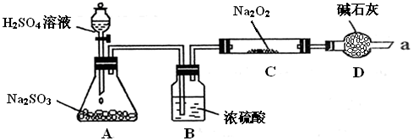
Ⅰ.装置B的作用是吸收水,干燥SO
2气体,其原因是(用离子方程式表示)
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.
装置D除了吸收过量的SO
2,避免污染空气外,还起到的作用是
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应
防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应
.
Ⅱ.某同学想通过上图实验装置,检验反应中是否有O
2生成时,其实验操作步骤是:
①先
打开分液漏斗上口瓶塞和下口旋塞
打开分液漏斗上口瓶塞和下口旋塞
;
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na
2SO
3; 假设2:只有Na
2SO
4;假设3:
有Na2SO3和Na2SO4
有Na2SO3和Na2SO4
.
(1)若假设2成立,写出所发生反应的化学方程式
Na2O2+SO2=Na2SO4
Na2O2+SO2=Na2SO4
.
(2)若Na
2O
2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na
2SO
4.该方案是否合理
否
否
(填“是”或“否”).
(3)设计实验验证假设3的实验步骤如下:
| 实验步骤 |
实验现象 |
| ①取C中固体产物少量于试管中,滴加入过量的稀盐酸 |
产生剌激性气味气体 |
| ②再向上述试管中滴加入适量的BaCl2溶液 |
产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
|
若假设3成立,正确的实验操作顺序是
③①②
③①②
.


