
题目列表(包括答案和解析)
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |

| ||
| 加热加压 |
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______ 。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______ ,电池工作时,固体电解质里的O2-向 _______ 极移动。
![]() (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 _______ ,第5~6min之间,改变的条件是 _______ 。T℃时该化 学反应的平衡常数是 _______ 。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______ 。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______ 0(填“>”、“=”、“<”).
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(若分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为
kJ。
(2)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为2Cu+H2OCu2O+H2
![]() 。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解池的阴极反应式为 。
。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解池的阴极反应式为 。
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(若分子式为CH4·9H2O)释放的甲 烷气体完全燃烧生成液态水.放出的热量为
烷气体完全燃烧生成液态水.放出的热量为
kJ。
(2)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为2Cu+H2O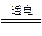 Cu2O+H2
Cu2O+H2 。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解
。该电解池中,铜电极接直流电源的 极;每生成1molCu2O,电路中通过的电子的数目为 ;该电解 池的阴极反应式为 。
池的阴极反应式为 。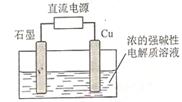
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.A 5.D 6.A
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
7.AD 8.D 9.B 10.AC 11.BD 12.C 13.D 14.A 15.BC
三.(本题包括2小题,共22分)
16.⑴cd ⑵①硫酸溶液、氢氧化钾溶液 ②1┱4
(除第⑴小题4分外,其余每空2分,共8分)
17.⑴①溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
②同时加入少量碘化钾固体,用适量水使之完全溶解 将第一步所得溶液全部转入1000mL的容量瓶中,定容,摇匀
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④ (每空2分,共14分)
四.(本题包括3小题,共30分)
18.⑴第三周期、ⅠA族 ⑵①C+4HNO3(浓)CO2↑+4NO2↑+2H2O
②2Na2O2+2CO2=2Na2CO3+O2 ⑶ (每空2分,共8分)
19.⑴①该晶体是分子晶体,各分子间存在较弱的分子间作用力,故“可燃冰”熔沸点较低
②890.3 kJ?mol-1
⑵①O2+4e=2 O2? 向负极移动 ②固体碳(或炭粒)
⑶寻找新能源,提高燃料的燃烧效率等
(每空2分,共12分)
20.⑴H2O2 ⑵acdefgj 合成塔 ⑥ ⑶Fe4S5+8O22Fe2O3+5SO2
(除第⑵小题第2、3空1分外,其余每空2分,共10分)
五.(本题包括2小题,共20分)
21.⑴乙基 C9H12O3 ⑵与NaOH溶液在加热条件下反应
⑶ (每空2分,共8分)
22.⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
⑶
⑷ HOOCCH2CHClCOOH+3NaOHNaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六.(本题包括2小题,共18分)
23.⑴CaCO3?MgCO3 (4分)
⑵由于炭粉过量,则白云石分解后的产物与炭粉反应完全,据氧元素守恒知,CaCO3?MgCO3→6CO,则V ==0.73am (4分)
24.⑴设乙烯总量为1mol,第①步反应消耗乙烯为xmol,则第②步产生的CH3COOH为x?75%×80%=0.6x。
由反应③知:=
即:x= 1-x=
故两次投料比为=x:(1-x)=5:3。 (4分)
⑵n(CH2=CH2)==1×106mol
m(CH3COOCH=CH2)=1×106mol××75%×86g/mol=2.42×107g=2.42×104kg(3分)
⑶ 第①步消耗氧气:n(O2)1=n(CH2=CH2)××=n(CH2=CH2)
第②步消耗氧气:n(O2)2=n(CH2=CH2)××75%×=n(CH2=CH2)
第③消耗氧气:n(O2)3=n(CH2=CH2)×=n(CH2=CH2)
n(O2)总=n(CH2=CH2)+n(CH2=CH2)+n(CH2=CH2)=n(CH2=CH2)
n(空气)=5×n(CH2=CH2)=n(CH2=CH2)
故:= (3分)
注:答题中出现的其它合理答案均给分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com