
题目列表(包括答案和解析)
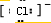
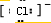
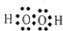
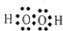
| ||
| ||
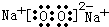
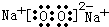


(12分)A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构。
(1)三种元素的名称。B ,D ,F 。
(2)A与D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
(3) A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为: ;只含离子键的化合物的电子式为: 。
(4)E离子的半径 (填“大于” “小于”或“等于”) F离子的半径 ;E 和F元素最高价氧化物对应的水化物之间反应的离子方程式为: 。
(5)写出由上述各种元素形成的粒子中与BC—电子数相等的三种分子的化学式 、 。
(12分)A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构。
(1)三种元素的名称。B ,D ,F 。
(2)A与 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
(3) A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为: ;只含离子键的化合物的电子式为: 。
(4)E离子的半径 (填“大于” “小于”或“等于”)F离子的半径;E 和F元素最高价氧化物对应的水化物之间反应的离子方程式为: 。
(5)写出由上述各种元素形成的粒子中与BC—电子数相等的三种分子的化学式 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com