
题目列表(包括答案和解析)
| |||||||||||||||||||
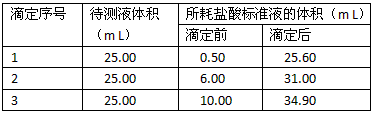
| 实验序号 | 消耗0.1 032 mol·L-1的盐酸溶液的体积/mL | 待测氢氧化钠溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
关于锥形瓶在中和滴定中的作用和使用方法的下列说法中,错误的是
A、用于盛装被滴定的溶液
B、使用前用蒸馏水洗后还必须用待测液润洗
C、若瓶中装入被滴定溶液量太少,可向瓶中加入一定量蒸馏水稀释
D、滴定时,应用左手依顺时针方向旋摇锥形瓶
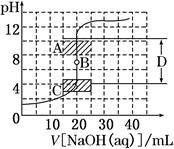
 某同学进行中和滴定实验,并绘制出如图所示的滴定曲线.下列有关该实验的说法正确的是( )
某同学进行中和滴定实验,并绘制出如图所示的滴定曲线.下列有关该实验的说法正确的是( )| A、锥形瓶中盛有NaOH溶液,指示剂为酚酞 | B、滴定管使用前先用待测液润洗,再用蒸馏水润洗 | C、滴定时,应时刻注视滴定管中液面的变化 | D、滴定终点附近,测试和记录pH的间隔要小 |
一、二选择题答案
1
2
3
4
5
6
B
D
D
A
C
C
7
8
9
10
11
12
A
C
D
C
D
C
13
14
15
16
17
18
B
C
D
A
D
D
19
20
21
22
23
D
B
C
B
A
三、
24、(7分)
(1) H : O : H (1分)
(2分)3NO2+H2O=2HNO3+NO
Cl2+H2O=HCl+HClO
2Na2O2+2H2O=4NaOH+O2↑
25、(6分)
(1) C 氧原子结构示意图 (每空1分)
 (2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
(2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
26、(8分)
(1)假设2:溶液中存在HCO3-
假设3:溶液中存在CO32-和HCO3-
假设4:溶液中存在CO32-和SO42-
假设5:溶液中存在SO42 、HCO3- (顺序不限。)(各1分)
(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的1mol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。
②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀部分溶解且有气体生成。说明原溶液中一定含有SO42-和CO32-。
③往装有滤液的试管中加入2mol/L盐酸;出现无色气体,说明原溶液中含有HCO3-。
((每空各1分。其他合理方案参照给分)
27、(13分)(1)不能 (1分) 温度高,水为气态,不利于氨气的生成 (2分)
(2) 25% (2分)K= (1分) 减小 减小 (2分)
(3) C3H3N6 (2分)6CO(NH2)2=6NH3+3CO2+C3H6N6 (2分)
N C N H H (1分)
28、(10分)
(1) 第四周期,第Ⅷ族 (2分)
(2) 3Fe3O4+8Al=9Fe+4Al2O3 (2分) 由来冶炼难熔金属(其他正确答案参照给分)(1分)
Al2O3+2OH-=2AlO2-+H2O (2分)
(3) Cl2+2Fe2+=2Fe3++2Cl- (1分) 3SCN-+Fe3+=Fe(SCN)3 (2分)
29、(15分)
⑴①阳离子交换膜 (2分) ② 2Cu2++4e-=2Cu 4OH-―4e-=2H2O+O2 (各1分)
(2)Cl2+2Br-=Br2+2Cl- (2分) BrO3- 5Br- (各1分)
分液漏斗 烧杯(各1分) ② (1分)
(3)H2S+HDO=HDS+H2O ③H2S(每空2分,共10分)
30、(15分)
(1)B (1分) 第4周期第IB族 (各1分) 1s22s22P63s23P63d104s1或[Ar] 3d104s1 (2分) (2) CO2 、CCl4 (其他合理答案参照给分)(各1分) 分子晶体 原子晶体 (各1分) (3) 7 1 (各1分) (4) IIIA IVA ; b (各1分)
A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于分子间作用力。(1分)
31、(15分)略
(1) (各1分)
(2) (各1分)
(3) (各2分)
(4) 3 3:2:2 (各1分)
(5) (各1分)

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com