
题目列表(包括答案和解析)

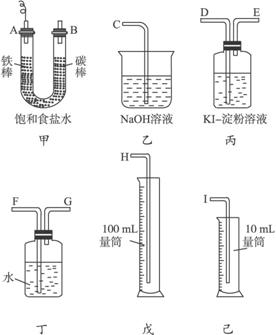
图4-20
(1)必要的仪器装置接口的顺序是:A接__________,B接_______。
(2)电路的连接顺序是:碳棒接电源的_________极,铁棒接电源的_________极,能说明氯气具有氧化性的实验现象是______________,有关离子方程式是__________________,Cl2被吸收的离子方程式是___________________。
(3)如果装入的饱和食盐水是50 mL(假定电解前后溶液体积不变),当测得的H2为5.6 mL (标准状况)时:
①停止通电,则另一极实际上可收集到氯气(填“<”“>”或“=”)5.6 mL,理由是________________。
②摇匀后,U形管内溶液的pH为__________。
合成氨时,假设其他条件相同,下列反应的混合物中,可以获得最多氨气产量的氢气、氮气的体积比是。
A.1 :1 B.6 :4 C.7 :3 D.8 :2
(10分) 有人设计了如下甲醇(methanol) 合成工艺:
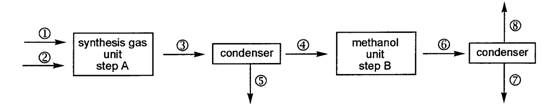
其中,①为甲烷气源,压强250.0kPa,温度25oC,流速55.0 m3s-1。②为水蒸气源,压强200.0kPa,温度150oC,流速150.0 m3s-1。合成气和剩余反应物的混合物经管路③进入25oC的冷凝器(condenser),冷凝物由管路⑤流出。在B中合成的甲醇和剩余反应物的混合物经⑥进入25oC的冷凝器,甲醇冷凝后经管路⑦流出,其密度为0.791gmL-1。
12-1. 分别写出在步骤A和步骤B中所发生的化学反应的方程式。
12-2. 假定:所有气体皆为理想气体,在步骤A和B中完全转化,气液在冷凝器中完全分离,计算经步骤A和步骤B后,在一秒钟内剩余物的量。
12-3. 实际上,在步骤B中CO的转化率只有三分之二。计算在管路⑥中CO、H2和CH3OH的分压(总压强为10.0 MPa)。
12-4. 当甲醇反应器足够大,反应达到平衡,管路⑥中的各气体的分压服从方程
一、二选择题答案
1
2
3
4
5
6
B
D
D
A
C
C
7
8
9
10
11
12
A
C
D
C
D
C
13
14
15
16
17
18
B
C
D
A
D
D
19
20
21
22
23
D
B
C
B
A
三、
24、(7分)
(1) H : O : H (1分)
(2分)3NO2+H2O=2HNO3+NO
Cl2+H2O=HCl+HClO
2Na2O2+2H2O=4NaOH+O2↑
25、(6分)
(1) C 氧原子结构示意图 (每空1分)
 (2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
(2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
26、(8分)
(1)假设2:溶液中存在HCO3-
假设3:溶液中存在CO32-和HCO3-
假设4:溶液中存在CO32-和SO42-
假设5:溶液中存在SO42 、HCO3- (顺序不限。)(各1分)
(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的1mol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。
②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀部分溶解且有气体生成。说明原溶液中一定含有SO42-和CO32-。
③往装有滤液的试管中加入2mol/L盐酸;出现无色气体,说明原溶液中含有HCO3-。
((每空各1分。其他合理方案参照给分)
27、(13分)(1)不能 (1分) 温度高,水为气态,不利于氨气的生成 (2分)
(2) 25% (2分)K= (1分) 减小 减小 (2分)
(3) C3H3N6 (2分)6CO(NH2)2=6NH3+3CO2+C3H6N6 (2分)
N C N H H (1分)
28、(10分)
(1) 第四周期,第Ⅷ族 (2分)
(2) 3Fe3O4+8Al=9Fe+4Al2O3 (2分) 由来冶炼难熔金属(其他正确答案参照给分)(1分)
Al2O3+2OH-=2AlO2-+H2O (2分)
(3) Cl2+2Fe2+=2Fe3++2Cl- (1分) 3SCN-+Fe3+=Fe(SCN)3 (2分)
29、(15分)
⑴①阳离子交换膜 (2分) ② 2Cu2++4e-=2Cu 4OH-―4e-=2H2O+O2 (各1分)
(2)Cl2+2Br-=Br2+2Cl- (2分) BrO3- 5Br- (各1分)
分液漏斗 烧杯(各1分) ② (1分)
(3)H2S+HDO=HDS+H2O ③H2S(每空2分,共10分)
30、(15分)
(1)B (1分) 第4周期第IB族 (各1分) 1s22s22P63s23P63d104s1或[Ar] 3d104s1 (2分) (2) CO2 、CCl4 (其他合理答案参照给分)(各1分) 分子晶体 原子晶体 (各1分) (3) 7 1 (各1分) (4) IIIA IVA ; b (各1分)
A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于分子间作用力。(1分)
31、(15分)略
(1) (各1分)
(2) (各1分)
(3) (各2分)
(4) 3 3:2:2 (各1分)
(5) (各1分)

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com