
题目列表(包括答案和解析)
(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH(g)+1/2O
(g)=CO(g)+2H
(g)
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH(g)+2O
(g)=CO2(g)+2H2O(g)
H2=-890.3kJ·mol
③CH(g)+CO
(g)=2CO(g)+2H
(g)
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为 。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。?
①b处电极上发生的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu的物质的量浓度 。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷 L (标准状况下)。
(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/( mol ·/L-1) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为 。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。?

①b处电极上发生的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH
(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu 的物质的量浓度
。
的物质的量浓度
。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷 L (标准状况下)。
下图是两座工厂的主要生产流程以及它们之间的生产关系
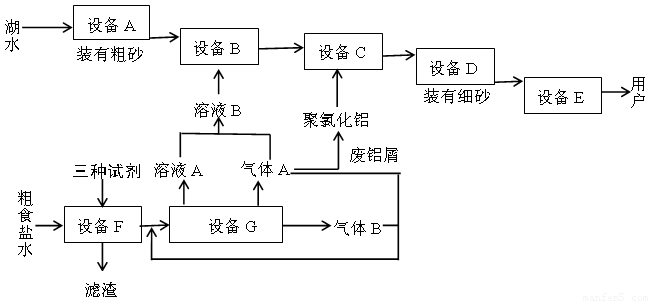
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是???????? 。
(2)“溶液B”也可以用下列物质中的什么物质代替?????? 。
a.KAl(SO4)2·12H2O????? b.ClO2??????? c.大量O3????? d.K2Cr2O7?????? e.活性炭
(3)聚氯化铝在生产过程中作??????? 剂,其作用是????????????? ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝):??????????????????????? 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为????????? 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式??????????????????????????? 。
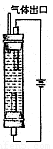
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应:????????????????????? 。
下图是两座工厂的主要生产流程以及它们之间的生产关系
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是 。
(2)“溶液B”也可以用下列物质中的什么物质代替? 。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7 e.活性炭
(3)聚氯化铝在生产过程中作 剂,其作用是 ,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝): 。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为 工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式 。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应: 。

 31.(18分)
31.(18分)
(一)
(1)结构或颠倒(2分)
(2)该个体为某一性状的杂合子,控制该性状的隐性基因不能表达(或基因的表达与环境因素有关)(2分)
(3)没有足够的核糖体合成蛋白质,导致幼虫体内蛋白质不足(2分)
(4)BXa、Y、Y(3分)
(二)
(1)细胞核(1分) 如果是细胞质遗传,则F1全为残翅。 (1分)
(2)能(1分),若F2代中雌果蝇全为灰体,雄果蝇既有灰体、又有黑体,则说明基因位于X染色体上;若灰体与黑体的性状与性别无关,则是常染色体上的遗传。 (2分)
(3)若F2代中出现灰体长翅、灰体残翅、黑体长翅和黑体残翅4种表现型,且比例接近9:3:3:1,则说明控制两对性状的基因分别位于两对同源染色体上。(2分)
否则说明控制两对性状的基因位于一对同源染色体上(2分)
化学参考答案和评分意见
6D
26.(1)NH4+ +
OH-  NH3↑ + H2O (2分) 稀硫酸(2分) 防倒吸(2分)
NH3↑ + H2O (2分) 稀硫酸(2分) 防倒吸(2分)
(2)使硫酸铵充分反应完全转化为NH3 (2分)
[交流讨论] A、B装置间缺一个干燥装置(2分)
增加赶尽反应装置中残留氨气的装置如在A装置连接一个鼓气装置等(2分)
用润湿的红色石蕊试纸靠近烧杯口,如果变蓝则有氨气逸出(2分)
[探究结论]不是 (2分)
 27.(14分)(1)FeCl3
(2分) (2)分子晶体(2分) (3)④ (2分) (4)3FeO+2Al 3Fe+Al2O3(2分)
27.(14分)(1)FeCl3
(2分) (2)分子晶体(2分) (3)④ (2分) (4)3FeO+2Al 3Fe+Al2O3(2分)
(5)FeS+2HCl=FeCl2+H2S↑ (2分) H2S+Cl2=S↓+2HCl(2分)
(6)2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl- (2分)
(或6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- )
28. (14分)
(1)70(2分)
 (2分)
(2分)
(2)①②③(2分)
(3)CH3COOH+CH3CH2OH  CH3COOCH2CH3 + H2O
(2分)
CH3COOCH2CH3 + H2O
(2分)
CH3CHO + 2Ag(NH3)2OH CH3COONH4
+ 2Ag + 3NH3 + H2O (2分)
CH3COONH4
+ 2Ag + 3NH3 + H2O (2分)


 (4) 3 (2分)
(4) 3 (2分)

(2分,其中任意一种均可)
(6)制造潜艇或用作航天材料等
物理参考答案和评分意见
题号
14
15
16
17
18
19
20
21
答案
A
AD
CD
C
A
A
D
AC
22、本题共17分
(1)(5分)C
(2)(每空3分,共12分)
0.400(0.399~0.401)
2.20V
23、(本题16分)
解:(1)(8分)

(2)(8分)

24、(本题19分)
解:(1)(9分)

(2)(10分)

25、(本题20分)
解:(1) (6分)

(2)(6分)

(3)(8分)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com