
题目列表(包括答案和解析)
下表标出的是元素周期表的一部分元素,回答下列问题:
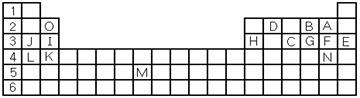
(1)表中用字母标出的15种元素中,金属性最强的主族元素是 (用元素符号表示,下同),非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 >
(用化学式表示)
(9分)下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,金属性最强的是 (用元素符号表示,下同),非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 > (用化学式表示)
(5)B的氢化物电子式为 用电子式表示G的氢化物形成过程 ,(物质用化学式表示)
(9分)下表标出的是元素周期表的一部分元素,回答下列问题:
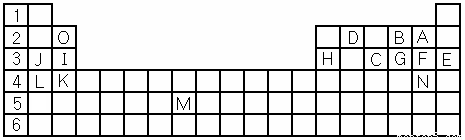
(1)表中用字母标出的15种元素中,金属性最强的是 (用元素符号表示,下同),非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 > (用化学式表示)
(5)B的氢化物电子式为 用电子式表示G的氢化物形成过程 ,(物质用化学式表示)
下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,金属性最强的主族元素是 (用元素符号表示,下同),非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 >
(用化学式表示)
(9分)下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,金属性最强的是 (用元素符号表示,下同),非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 > (用化学式表示)
(5)B的氢化物电子式为 用电子式表示G的氢化物形成过程 ,(物质用化学式表示)
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依题意知,
.依题意知,


 .所以
.所以 与
与 反应的方程式为
反应的方程式为

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与 恰好完全反应时,消耗
恰好完全反应时,消耗 的质量为:
的质量为: 时;0.3 mol HCl与
时;0.3 mol HCl与 恰好完全反应,消耗
恰好完全反应,消耗 的质量为:0.3×84=
的质量为:0.3×84=
(1)a≤ 、
、 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
 x=
x=
(2)a> 不足,且对于
不足,且对于 恰好完全反应时,加入
恰好完全反应时,加入 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
 x=2,
x=2,
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15. 、
、 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的 、
、 与酸完全反应时,生成
与酸完全反应时,生成 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:

由方程式可知: .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与 反应.假设反应后无
反应.假设反应后无 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:

由方程式可知此时 .因为有水生成,所以
.因为有水生成,所以
(3)当 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、 ;排出气体为
;排出气体为 .
.
(4)当排出的 和
和 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:

2b b b

b b 
设反应的 的物质的量为x
的物质的量为x

x x 
依题意有:

所以,反应中消耗 的物质的量为:
的物质的量为: ,用去
,用去 的物质的量为:
的物质的量为:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃时, 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~ 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去

179 143

(3)100℃~ 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~ 发生了分解
发生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为
(5)280℃~ 反应生成高价态氧化物
反应生成高价态氧化物
 方程式为
方程式为

29.解:假设反应后的混合物标况下仍为气体且体积为 ,由
,由 ,得
,得
 ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为 ,体积为x,则CO为
,体积为x,则CO为
由 体积减少
体积减少

 体积增加
体积增加
 nL (n+1)L
nL (n+1)L 
x

据题意得: nx=
nx=
讨论:(1)n=l时,x=
(2)n=2时,
(3)n=3时,
(4)n=4时,
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:
析出小苏打的质量为:
(2) 和
和
当降温至 的质量为:
的质量为:

析出 的质量为:
的质量为:
 共析出晶体的质量为:
共析出晶体的质量为: www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com