
题目列表(包括答案和解析)
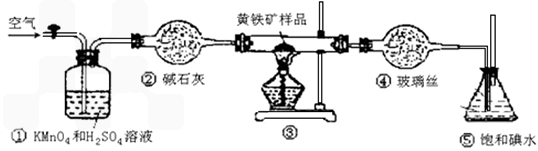
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
|
滴定次数 |
待测液体的体积/mL |
标准碱溶液的体积/mL |
|
|
滴定前 |
滴定后 |
||
|
第一次 |
20.00mL |
0.00 |
20.58 |
|
第二次 |
20.00mL |
0.22 |
20.20 |
|
第三次 |
20.00mL |
0.36 |
20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是

A.20℃时,硝酸钾饱和溶液的质量分数是31.6%
B.30℃时,将35 g硝酸钾和35g食盐同时溶于l00g水中,蒸发时先析出的是氯化钠
C.40℃时,35 g食盐溶于l00 g水中,降温至0C时,可析出氯化钠晶体
D.60℃时,200 g水中溶解80 g硫酸铜达饱和,当降温至30℃时,可析出30g硫酸铜晶体

1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依题意知,
.依题意知,


 .所以
.所以 与
与 反应的方程式为
反应的方程式为

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与 恰好完全反应时,消耗
恰好完全反应时,消耗 的质量为:
的质量为: 时;0.3 mol HCl与
时;0.3 mol HCl与 恰好完全反应,消耗
恰好完全反应,消耗 的质量为:0.3×84=
的质量为:0.3×84=
(1)a≤ 、
、 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
 x=
x=
(2)a> 不足,且对于
不足,且对于 恰好完全反应时,加入
恰好完全反应时,加入 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
 x=2,
x=2,
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15. 、
、 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的 、
、 与酸完全反应时,生成
与酸完全反应时,生成 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:

由方程式可知: .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与 反应.假设反应后无
反应.假设反应后无 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:

由方程式可知此时 .因为有水生成,所以
.因为有水生成,所以
(3)当 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、 ;排出气体为
;排出气体为 .
.
(4)当排出的 和
和 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:

2b b b

b b 
设反应的 的物质的量为x
的物质的量为x

x x 
依题意有:

所以,反应中消耗 的物质的量为:
的物质的量为: ,用去
,用去 的物质的量为:
的物质的量为:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃时, 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~ 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去

179 143

(3)100℃~ 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~ 发生了分解
发生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为
(5)280℃~ 反应生成高价态氧化物
反应生成高价态氧化物
 方程式为
方程式为

29.解:假设反应后的混合物标况下仍为气体且体积为 ,由
,由 ,得
,得
 ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为 ,体积为x,则CO为
,体积为x,则CO为
由 体积减少
体积减少

 体积增加
体积增加
 nL (n+1)L
nL (n+1)L 
x

据题意得: nx=
nx=
讨论:(1)n=l时,x=
(2)n=2时,
(3)n=3时,
(4)n=4时,
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:
析出小苏打的质量为:
(2) 和
和
当降温至 的质量为:
的质量为:

析出 的质量为:
的质量为:
 共析出晶体的质量为:
共析出晶体的质量为: www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com