
题目列表(包括答案和解析)
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
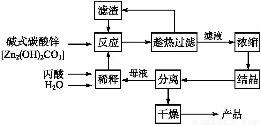
序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
1 | 1∶0.25 | 60 | 67.2 |
2 | 1∶0.25 | 80 | 83.5 |
3 | 1∶0.25 | 100 | 81.4 |
4 | 1∶0.31 | 60 | 89.2 |
5 | 1∶0.31 | 80 | 90.1 |
6 | 1∶0.31 | 100 | 88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
在容器体积可变的密闭容器中,反应N2(g)![]() 3H2(g)
3H2(g) ![]() 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.6mol/L,在此期间,正反应速率![]() (H2)的值为
(H2)的值为
A.0.6mol/(L·s) B.0.45 mol/(L·s) C.0.3 mol/(L·s) D.0.2 mol/(L·s)
(2)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正 (选填“增大”、“减小”,下同),v逆 ,平衡向 方向移动(选填“正反应”、“逆反应”)。
 (3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为 反应(选填“吸热”、“放热”)。
(3)在其他条件不变的情况下,降低温度平衡向正反应方向移动,则正反应为 反应(选填“吸热”、“放热”)。
(4)右图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是 (填写编号)。
a.增大N2的浓度 b.扩大容器体积
c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量 (选填“增大”、“减小”、“不变”)。
(5)若达到平衡时,n(N2)∶n(H2)∶n(NH3)![]() 。保持温度不变,以
。保持温度不变,以![]() 的物质的量之比再充入N2、H2、NH3,则
的物质的量之比再充入N2、H2、NH3,则
A.平衡向正反应方向移动 B.平衡不移动
C.平衡时,NH3的体积分数增大 D.平衡时,NH3的体积分数可能减小
(2013?江苏三模)下表为六种短周期元素的部分性质.
|
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依题意知,
.依题意知,


 .所以
.所以 与
与 反应的方程式为
反应的方程式为

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与 恰好完全反应时,消耗
恰好完全反应时,消耗 的质量为:
的质量为: 时;0.3 mol HCl与
时;0.3 mol HCl与 恰好完全反应,消耗
恰好完全反应,消耗 的质量为:0.3×84=
的质量为:0.3×84=
(1)a≤ 、
、 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
 x=
x=
(2)a> 不足,且对于
不足,且对于 恰好完全反应时,加入
恰好完全反应时,加入 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
 x=2,
x=2,
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15. 、
、 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的 、
、 与酸完全反应时,生成
与酸完全反应时,生成 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:

由方程式可知: .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与 反应.假设反应后无
反应.假设反应后无 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:

由方程式可知此时 .因为有水生成,所以
.因为有水生成,所以
(3)当 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、 ;排出气体为
;排出气体为 .
.
(4)当排出的 和
和 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:

2b b b

b b 
设反应的 的物质的量为x
的物质的量为x

x x 
依题意有:

所以,反应中消耗 的物质的量为:
的物质的量为: ,用去
,用去 的物质的量为:
的物质的量为:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃时, 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~ 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去

179 143

(3)100℃~ 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~ 发生了分解
发生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为
(5)280℃~ 反应生成高价态氧化物
反应生成高价态氧化物
 方程式为
方程式为

29.解:假设反应后的混合物标况下仍为气体且体积为 ,由
,由 ,得
,得
 ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为 ,体积为x,则CO为
,体积为x,则CO为
由 体积减少
体积减少

 体积增加
体积增加
 nL (n+1)L
nL (n+1)L 
x

据题意得: nx=
nx=
讨论:(1)n=l时,x=
(2)n=2时,
(3)n=3时,
(4)n=4时,
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:
析出小苏打的质量为:
(2) 和
和
当降温至 的质量为:
的质量为:

析出 的质量为:
的质量为:
 共析出晶体的质量为:
共析出晶体的质量为: www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com