
题目列表(包括答案和解析)
(1)将饱和氯化铁溶液滴入沸水,煮沸至液体呈红褐色停止加热,反应的离子方程式是:
_____________ _________。将此液体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现 (填阳极或者阴极)附近的颜色加深。
(2)下列实验设计或操作合理的是_____ ___。
A.在催化剂存在的条件下,苯和溴水发生反应可生成比水重的溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
D.将10滴溴乙烷加入1mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
H.为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验
| ||
| ||
下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O 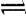 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.钠与水反应:Na+2H2O=Na++H2↑+OH-
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-
下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O 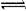 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3+ + 4OH-= AlO2- + 2H2O
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-
下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.钠与水反应:Na+2H2O=Na++H2↑+OH-
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2= 2Fe3+ +2Br-
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱电解质
;生成了弱电解质 ,破坏了
,破坏了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的电离,
的电离,

 ,同时还存在
,同时还存在 离子的水解,
离子的水解,

 ,
, 溶液呈弱碱性,说明
溶液呈弱碱性,说明 的水解反应占优势.
的水解反应占优势.
(2) 在溶液中存在着
在溶液中存在着 离子的电离,同时又存在
离子的电离,同时又存在 离子的水解,
离子的水解, 呈弱酸性说明
呈弱酸性说明 离子的电离比水解来得强.
离子的电离比水解来得强.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉红 


(2)放出气体,溶液变浑浊,红色加深红

27.(1)溶液变成紫红色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因
才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因 的溶解和
的溶解和 的继续生成导致,且溶解的
的继续生成导致,且溶解的 的物质的量和生成的
的物质的量和生成的 物质的量相等.故加入的物质:
物质的量相等.故加入的物质:
 这段的离子方程式为:
这段的离子方程式为:


②第一段生成的沉淀为 、
、 和
和 ,且B为90 mL时,
,且B为90 mL时, 、
、 恰好沉淀完全.这段反应的离子方程式为:
恰好沉淀完全.这段反应的离子方程式为: ,
,
 ,
,
③图中曲线第三段(100-110 mL),B为100 mL时 恰好沉淀完全.这段中
恰好沉淀完全.这段中 继续溶解,B为110 mL时,沉淀中
继续溶解,B为110 mL时,沉淀中 已完全溶解.这段中溶解了
已完全溶解.这段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,则100 mL时,共加入
,则100 mL时,共加入 为0.1 mol,共生成
为0.1 mol,共生成 ,故A溶液中
,故A溶液中 .这段
.这段 溶解的离子方程式为:
溶解的离子方程式为:
④图中曲线第四段中,沉淀为 、
、 共0.11 mol,则
共0.11 mol,则
 为0.11 mol,A中
为0.11 mol,A中 .
.
⑤第二、三段间共消耗 ,则共溶解的
,则共溶解的 为0.02 mol,则A中
为0.02 mol,则A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com