
题目列表(包括答案和解析)
|
向某溶液加入过量的HCl析出白色沉淀,过滤后向滤液中加入过量的氨水,使溶液呈碱性,又有白色沉淀析出,再经过滤,向滤液中加入纯碱溶液,仍有白色沉淀析出,则原溶液中含有的阳离子是 | |
A. |
Ag+,Cu2+,Zn2+ |
B. |
|
C. |
Ag+,Ca2+,Mg2+ |
D. |
Ag+,Al3+,Ba2+ |
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出.这四种金属的活动性由强到弱的顺序是________.
(2)向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为________.
(3)现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是________
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液________
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.此电池的负极发生的电极反应式是________;
镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: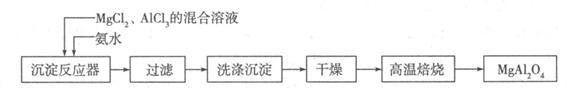
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)。
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 。
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。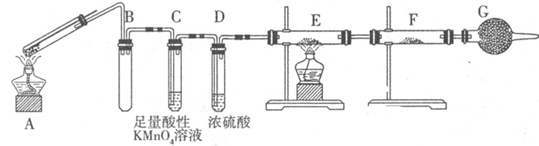
(1)G装置的作用是 。
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 。
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 。

1.D 2.C 3.C 4.B 5.D 6.CD 7.B 8.AC 9.A 10.D 11.C 12.AB
13.D 14.D 15.A 16.B 17.B 18.C 19.D 20.B 21.B 22.B
23.(1)A.坩埚 B.蒸发皿 C.分液漏斗 D.蒸馏烧瓶 E.漏斗 F.酒精灯 G.干燥管
(2)①G ②C ③D、F ④E ⑤B、F
24.(1)I (2) ;
; (3)溶解放热,并提供大量的
(3)溶解放热,并提供大量的
(4)①
②
25.分解与解答:(1)电子氧化性 ,而Cu、Fe、Zn全部液解,故一定有
,而Cu、Fe、Zn全部液解,故一定有 、
、 、
、 ,可能还有
,可能还有 、
、
(2)根据氧化还原反应进行的次序规律,因还原性Zn>Fe>Cu,若剩余固体W/ 与Cu反应,
与Cu反应, 与Cu不反应,故一定有
与Cu不反应,故一定有 、
、 ,可能还有
,可能还有 ,一定没有
,一定没有 、
、
(3)剩余固体为Cu、Fe、Zn,只有部分Zn溶解,加之 、
、 均要与Fe反应,故一定有
均要与Fe反应,故一定有 、
、 ,一定没有
,一定没有 、
、 、
、
26.(1)①x=1,y=1;②6、2、4=1、3、2、4;
③
(2) ;Mn
;Mn
27.(1) ;
;
(2) ;
;
(3) ;
;

28.(1)①C ②
(2) ;
; ;在
;在 分子中,C、H质量比为12∶4,在
分子中,C、H质量比为12∶4,在 混入任何比例的
混入任何比例的 都将使C、H质量比小于12∶4;1∶3 25%
都将使C、H质量比小于12∶4;1∶3 25%
(2) 或0.1500 V
%
或0.1500 V
%
(3)C
30.(1)2;5
W、 ;W、
;W、 ;W、
;W、 ;
; 、
、 ;
; 、
、
(2) 或
或 或
或
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com