
题目列表(包括答案和解析)
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s)
,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s)
,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
起始
n(A)/mol 起始
n(B)/mol 起始
n(C)/mol 起始
n(D)/mol 达到平衡时放出(或吸收)的热量
0 1.6 8 足量
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H = +131.3 kJ•mol-1
CO (g) +H2 (g) △H = +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
 (2)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
(2)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(3)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ________ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正____ν逆 |
(4)己知:2C (s) + O2(g) = 2CO (g) △H = -221.0 kJ·mo1-1
2CO(g) + O2(g) = 2CO2 (g) △H = -566.0 kJ·mo1-1
2H2 (g) + O2 (g) = 2H2O (g) △H = -483.6 kJ·mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为△H = kJ/mol。
 CO(g)+H2(g) △H= +131.3kJ·mol-1
CO(g)+H2(g) △H= +131.3kJ·mol-1 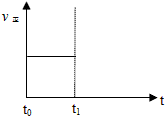

1
2
3
4
5
6
7
8
C
D
D
D
C
B
B
D
9
10
11
12
13
14
D
BC
BC
B
AB
CD
15.(10分) (1)① 氟离子 结构示意图 (1分)
② 取形状大小相同的镁片和铝片分别与体积相同、浓度相同的稀盐酸反应,观察产生气泡的快慢 (2分)(操作1分,观察指标1分。着重号部分缺一处扣1分。用金属与沸水反应、等浓度盐溶液碱性比较等合理方法均得分,方案无可行性不给分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化学式错得0分,配平错扣1分)
有白色胶状沉淀生成,有无色刺激性气味气体产生 (2分)
(各占1分,着重号部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 强 (1分)
16.(11分)(1)除去表面的油污 CO32- + H2O  HCO3- + OH- (2分)
HCO3- + OH- (2分)
(2)不再有气泡产生(或只有极少量气泡产生) (1分)
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全
(两个方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化学式错得0分,配平错扣1分)
(5)6.6 (2分) (多写单位g不扣分)
(6)循环使用 (2分(具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
17.(11分)
(1)2MnO4- +
5H
(化学式错得0分,配平错扣1分,漏↑扣1分,扣完为止)
(2)4 (2分)
(3)① 反应开始时:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反应时间: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反应速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成计算且结果正确得3分,结果错误得0分。速率单位错误扣1分)
② 否(或:不可行) (1分) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
(基本思路错误得0分,思路正确未强调草酸过量扣1分,未强调体积相同扣1分)
18


19.(12分)(1)增大 (1分)(2)不移动 (1分)(3)(4分)(各占2分,起点位置、曲线走势、终点与原曲线的相对高低等只要有一处错误则得0分。)
(4)(4分)0.60(2分) ν正_>_ν逆(2分)
(5)-787.0 (2分)(不带负号得0分,有效数字不准确扣1分。)
20.(每空2分,共10分)
(1) (2分) (2)均为氧化还原反应 (2分)
(2分) (2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+6H++3NO3-=Fe3++3NO2↑+3 H2O
3 Fe+8H++2NO3-=3Fe2++2NO ↑+4H2O (共2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
21(1)a、d(1分); (2)3:2:3(1分); (3)C3H4O4(1分);


 (4)
+ CH2(COOH) 2
+H2O(2分)
(4)
+ CH2(COOH) 2
+H2O(2分)
(5)4种 (2分) (写出下列四种结构中的任意一种均可得2分)
 |
22.(10分)(1) C F (2分) (漏选1个扣1分,多选一个也扣1分,扣完为止。)
(2)① 3 (1分) 2 (1分)
② HCO3-中含有O-H键,相互之间可通过O-H┅O氢键缔合(1分)
(写出HCO3-化学式并指出离子之间有氢键作用才能得分)
(3)断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol, 断裂一个π键CO比N2更容易,所以CO更活泼。(2分)
 (叙述清楚,未具体计算出数值不扣分。)
(叙述清楚,未具体计算出数值不扣分。)
(4)① 1s22s22p63s23p63d84s2 (1分)
② 分子晶体 (1分)
③ (1分)
23.(10分) (1)FeC2O4?2H2O FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3
FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3 4Fe3O4+O2↑
4Fe3O4+O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com