
题目列表(包括答案和解析)
(12分)
![]() 某厂废水中含5.00×10-3mol?L-1的
某厂废水中含5.00×10-3mol?L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
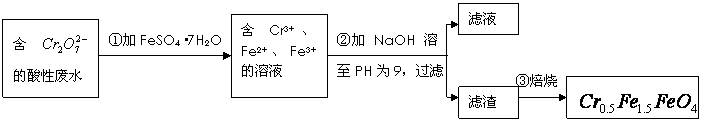
![]()
![]()
![]()
![]()
(1)第①步反应的离子方程式是
![]() (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:
![]()
![]() (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
![]() (4)欲使1L该废水中的
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入 GFeSO4?7H2O。
。理论上需要加入 GFeSO4?7H2O。
(12分)三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]?3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol?L-1HNO3、1.0 mol?L-1盐酸、1.0 mol?L-1 NaOH、3% H2O2 、0.1mol?L-1KI、0.1 mol?L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤 | 预期现象与结论 |
步骤1: | |
步骤2: | |
步骤3: | |
…… |
A.溶液中[Fe2+]<[Fe3+] B.溶液中[Fe2+]>[Fe3+]?
C.部分铁被氧化 D.部分Fe3+被还原?
( 12分 ) ( 1 ) 在试管里加入2 mL蛋白质溶液,然后加入2 mL甲醛溶液,可以看_____,把少量沉淀放入盛有蒸馏水的试管里,沉淀 __________ 。
( 2 ) 1995年美国科学家Lagow报道,他制得了碳的第四种同素异形体——链式炔碳。…—C≡C—C≡C—C≡C—C≡C—…有300~500个碳原子,该物质很活泼。回答下列问题:
①链式炔碳的熔点,估计比石墨 ________ ( 填“高”或“低” ) 。
②推测链式炔碳C300经适当处理可得含多个C≡C的链状化合物C300H296,该分子中含C≡C最多可达个 ________ 。
( 3 ) 高分子 水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。
水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。
1
2
3
4
5
6
7
8
C
D
D
D
C
B
B
D
9
10
11
12
13
14
D
BC
BC
B
AB
CD
15.(10分) (1)① 氟离子 结构示意图 (1分)
② 取形状大小相同的镁片和铝片分别与体积相同、浓度相同的稀盐酸反应,观察产生气泡的快慢 (2分)(操作1分,观察指标1分。着重号部分缺一处扣1分。用金属与沸水反应、等浓度盐溶液碱性比较等合理方法均得分,方案无可行性不给分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化学式错得0分,配平错扣1分)
有白色胶状沉淀生成,有无色刺激性气味气体产生 (2分)
(各占1分,着重号部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 强 (1分)
16.(11分)(1)除去表面的油污 CO32- + H2O  HCO3- + OH- (2分)
HCO3- + OH- (2分)
(2)不再有气泡产生(或只有极少量气泡产生) (1分)
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全
(两个方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化学式错得0分,配平错扣1分)
(5)6.6 (2分) (多写单位g不扣分)
(6)循环使用 (2分(具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
17.(11分)
(1)2MnO4- +
5H
(化学式错得0分,配平错扣1分,漏↑扣1分,扣完为止)
(2)4 (2分)
(3)① 反应开始时:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反应时间: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反应速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成计算且结果正确得3分,结果错误得0分。速率单位错误扣1分)
② 否(或:不可行) (1分) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
(基本思路错误得0分,思路正确未强调草酸过量扣1分,未强调体积相同扣1分)
18


19.(12分)(1)增大 (1分)(2)不移动 (1分)(3)(4分)(各占2分,起点位置、曲线走势、终点与原曲线的相对高低等只要有一处错误则得0分。)
(4)(4分)0.60(2分) ν正_>_ν逆(2分)
(5)-787.0 (2分)(不带负号得0分,有效数字不准确扣1分。)
20.(每空2分,共10分)
(1) (2分) (2)均为氧化还原反应 (2分)
(2分) (2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+6H++3NO3-=Fe3++3NO2↑+3 H2O
3 Fe+8H++2NO3-=3Fe2++2NO ↑+4H2O (共2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
21(1)a、d(1分); (2)3:2:3(1分); (3)C3H4O4(1分);


 (4)
+ CH2(COOH) 2
+H2O(2分)
(4)
+ CH2(COOH) 2
+H2O(2分)
(5)4种 (2分) (写出下列四种结构中的任意一种均可得2分)
 |
22.(10分)(1) C F (2分) (漏选1个扣1分,多选一个也扣1分,扣完为止。)
(2)① 3 (1分) 2 (1分)
② HCO3-中含有O-H键,相互之间可通过O-H┅O氢键缔合(1分)
(写出HCO3-化学式并指出离子之间有氢键作用才能得分)
(3)断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol, 断裂一个π键CO比N2更容易,所以CO更活泼。(2分)
 (叙述清楚,未具体计算出数值不扣分。)
(叙述清楚,未具体计算出数值不扣分。)
(4)① 1s22s22p63s23p63d84s2 (1分)
② 分子晶体 (1分)
③ (1分)
23.(10分) (1)FeC2O4?2H2O FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3
FeC2O4+2H2O,加热 减少的质量等于所含结晶水的质量 (2)FeO、CO、CO2;1:1:1。(3)30%。(4)6Fe2O3 4Fe3O4+O2↑
4Fe3O4+O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com